Chemische Bindungen
Nur die Edelgase (18. Gruppe im PSE) treten atomar (d.h. als einzelne Atome) auf. Alle anderen Elemente kommen auf der Erde nicht einzeln, sondern in Verbindungen vor. Dabei unterscheidet man die Ionenbindung, die Metallbindung und die Elektronenpaarbindung (Atombindung).
Info für Lehrer*innen
Mehr zu SchuBu+
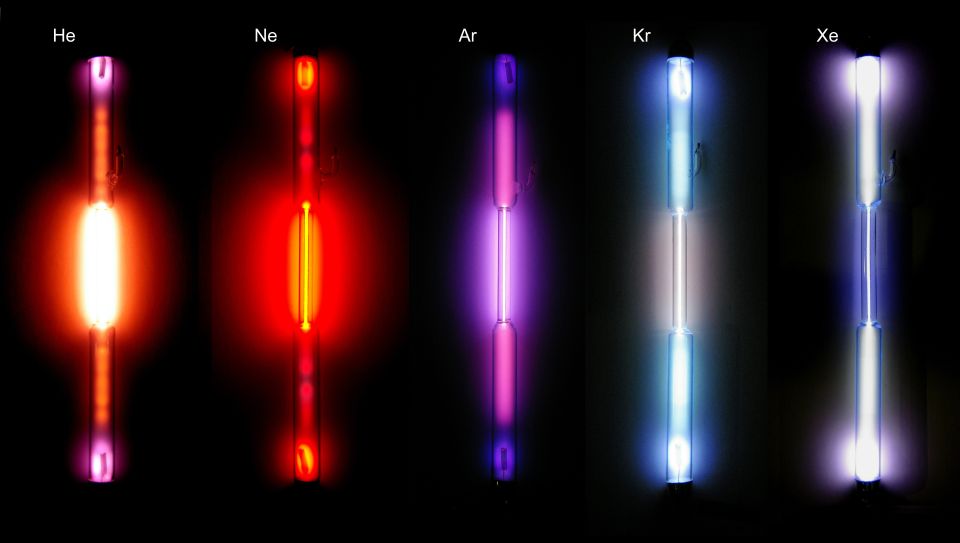
Edelgase
Edelgase sind bei Raumtemperatur gasförmig. Sie sind unreaktiv, das heißt sie zeigen kein Bestreben, Verbindungen einzugehen. Wechselwirkungen mit anderen Atomen sind sehr selten. Betrachtet man ihren Atombau, so erkennt man eine Gemeinsamkeit: eine volle Außenschale. Eine Außenschale gilt als voll, wenn sich 8 Elektronen darin befinden (mit Ausnahme der ersten Schale, hier befinden sich max. 2 Elektronen).
Edelgasregel (Oktettregel)
Eine volle Außenschale bewirkt einen energetisch günstigen, stabilen Zustand. Daher sind die Elemente der Gruppe 1 bis 17 bestrebt, zwei (1. Periode) beziehungsweise 8 Elektronen in der Außenschale zu erreichen. Dieses Bestreben bezeichnet man als Edelgasregel. Bei den Elementen ab der 2. Periode spricht man aufgrund der Anzahl der Elektronen auch von der Oktettregel (octo ist lateinisch und bedeutet acht). Den Edelgaszustand erreichen die Elemente der Gruppen 1 bis 17 durch das Eingehen von Bindungen.
Metalle und Nichtmetalle
Man kann alle Elemente in 3 große Gruppen einteilen: Metalle, Halbmetalle und Nichtmetalle. Ein Blick auf das PSE zeigt, dass es mehr Metalle als Nichtmetalle gibt. Nichtmetalle finden sich – bis auf Wasserstoff – rechts im PSE. Halbmetalle stehen im PSE zwischen den Metallen und den Nichtmetallen und zeigen Eigenschaften dieser beiden Gruppen.
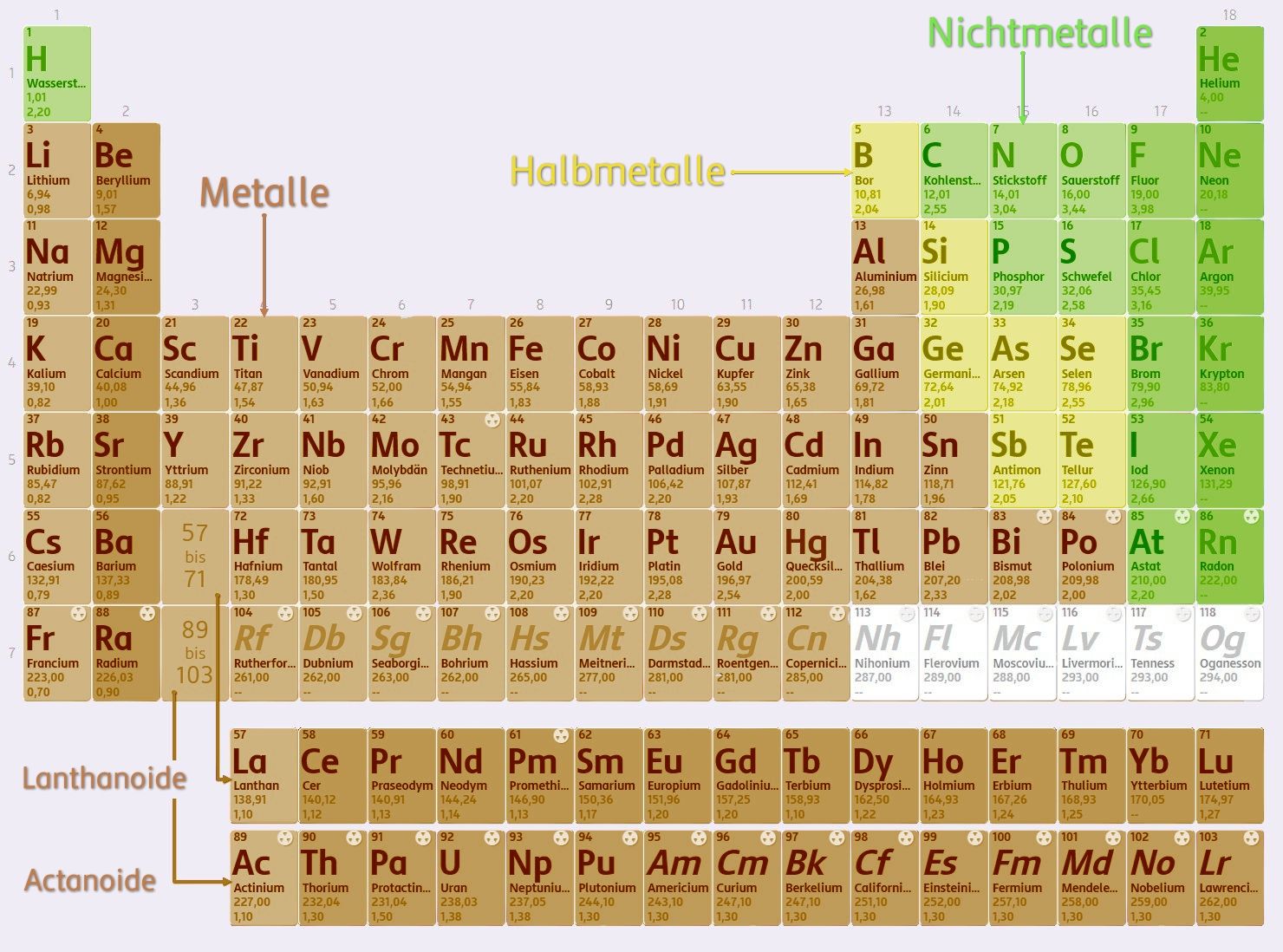
Die Unterscheidung zwischen Metallen und Nichtmetallen spielt unter anderem bei der Beschreibung von chemischen Bindungen eine wichtige Rolle.
Elektronegativität
Metalle und Nichtmetalle unterscheiden sich unter anderem in ihrer Tendenz, Elektronen abzugeben oder Elektronen aufzunehmen. Die Elektronegativität (EN) gibt Auskunft über das Bestreben von Atomen, Elektronen an sich zu ziehen. Die Werte für die Elektronegativität wurden experimentell ermittelt.
Ein Blick auf das PSE zeigt, dass Fluor das Element mit der höchsten Elektronegativität ist. Metalle haben im Vergleich zu Nichtmetallen geringe Elektronegativität und geben daher Elektronen ab.
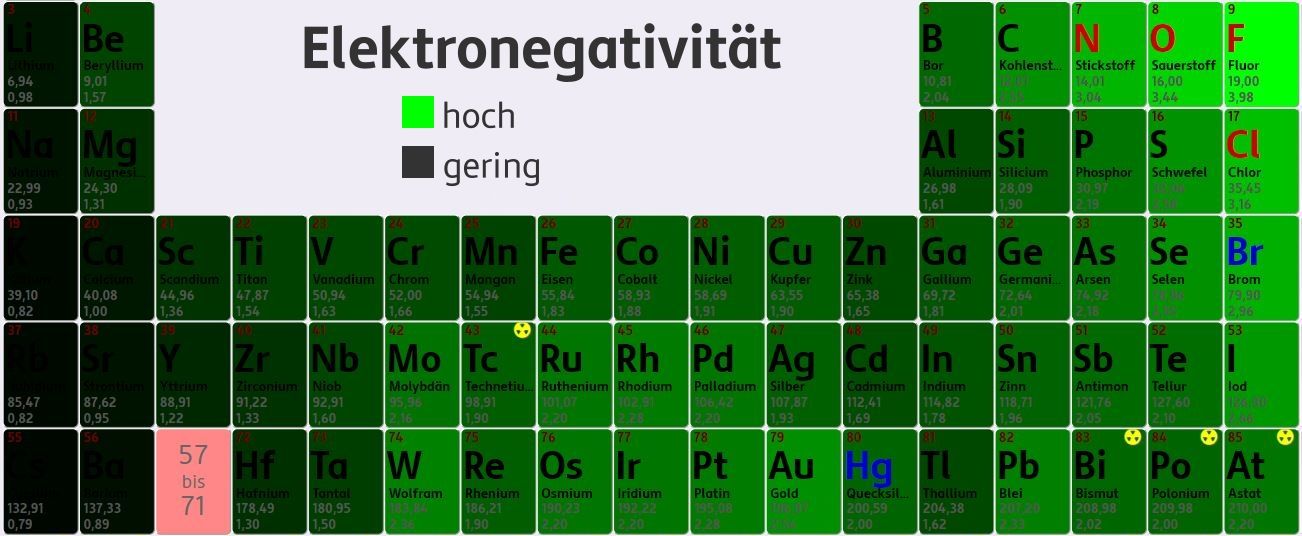
Überlege, warum die Elemente der 18. Gruppe hier nicht angeführt sind!
Die 18. Gruppe sind die Edelgase. Diese haben kein Bestreben sich zu binden, da sie bereits in einem energetisch günstigen, stabilen Zustand vorliegen. Daher ist kein Wert für die Elektronegativität angegeben.
Bindungsarten
Die Edelgasregel und die chemischen Eigenschaften der Metalle und Nichtmetalle führen zu drei unterschiedlichen Bindungstypen (zwischen denen es auch Übergänge gibt). Dabei kommt es zu Änderungen in den Außenschalen der Atome.

Ionenbindung
Es bilden sich Ionen durch die Übertragung von Elektronen von Metallatomen auf Nichtmetallatome. Dadurch entstehen Ionen, die sich gegenseitig anziehen und zu regelmäßigen Ionengittern anordnen. Es bilden sich Salze (z. B. Kochsalz/NaCl).
Metallbindung
Metallatome geben zur Erfüllung der Edelgasregel ihre Außenelektronen ab. Diese frei beweglichen Elektronen bilden ein Elektronengas. Die Metall-Ionen bilden regelmäßige Metallgitter. Es entstehen Metalle (z. B. Natrium/Na).
Elektronenpaarbindung (Atombindung)
Nichtmetallatome teilen sich Außenelektronen und erreichen damit eine volle Außenschale. Dabei bilden sich Elektronenpaare, zu denen jedes Atom ein Elektron beisteuert. Es entstehen Moleküle (z. B. Wasser/H2O).