Atommodelle vor dem 20. Jahrhundert
Schon in der Antike hat man sich über den Aufbau von Stoffen Gedanken gemacht. Aus vielen Ideen und Erkenntnissen haben sich die heutigen Atommodelle entwickelt. Sie stellen ein Abbild der Wirklichkeit dar und helfen dabei, sich Inhalte besser vorstellen zu können.
Info für Lehrer*innen
Mehr zu SchuBu+
Atommodelle in der Antike
Demokrit (um 400 v. Chr.) stellte sich vor, dass alle Stoffe aus kleinsten, unteilbaren Teilchen aufgebaut sind. Er gab diesen Teilchen den Namen Atome (atomos ist griechisch und bedeutet unteilbar). Laut Demokrit sind alle Atome aus der gleichen Ursubstanz, haben aber unterschiedliche Größen und Formen.
Atommodell nach Dalton (1808)
John Dalton griff die Beschreibung von Demokrit auf und stellte sich Atome als kleine Kügelchen vor (Kugelteilchenmodell).
Dalton postulierte, dass alle Atome eines Grundstoffes
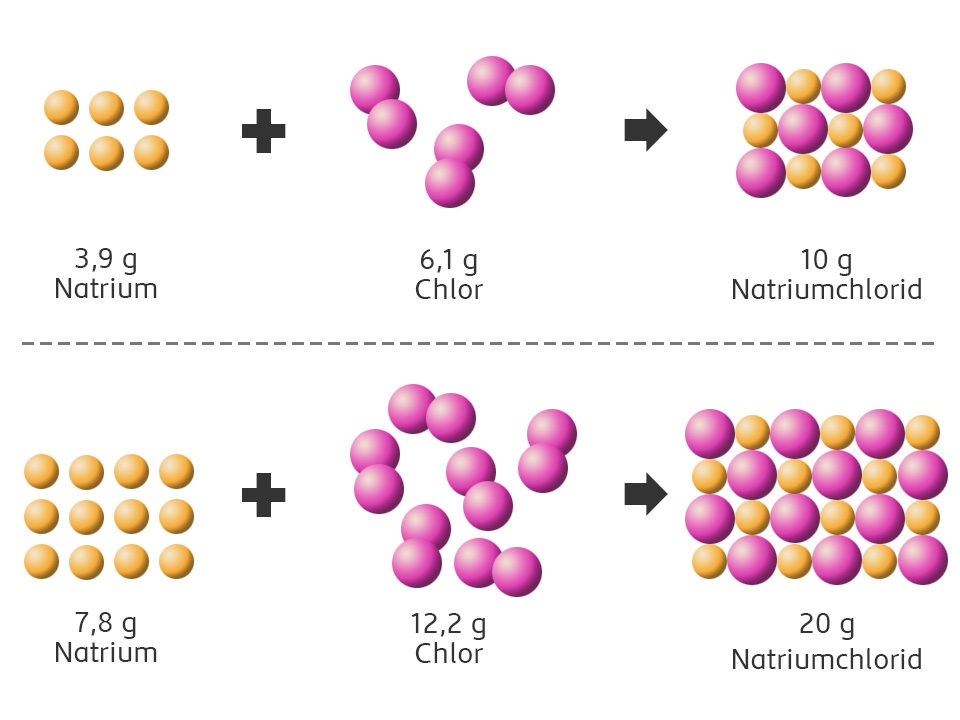
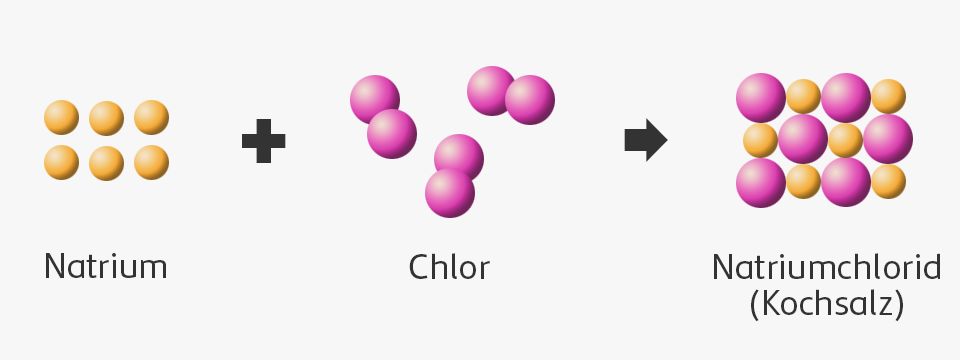
Dalton beschrieb chemische Reaktionen als Vorgänge, bei denen sich Atome anders anordnen und in einem bestimmten Verhältnis zueinander neue Verbindungen bilden.
Mit dem Kugelteilchenmodell lassen sich auch die Aggregatzustände darstellen.
Chemische Grundgesetze
Mit Daltons Atommodell können zwei wichtige Grundgesetze dargestellt werden.
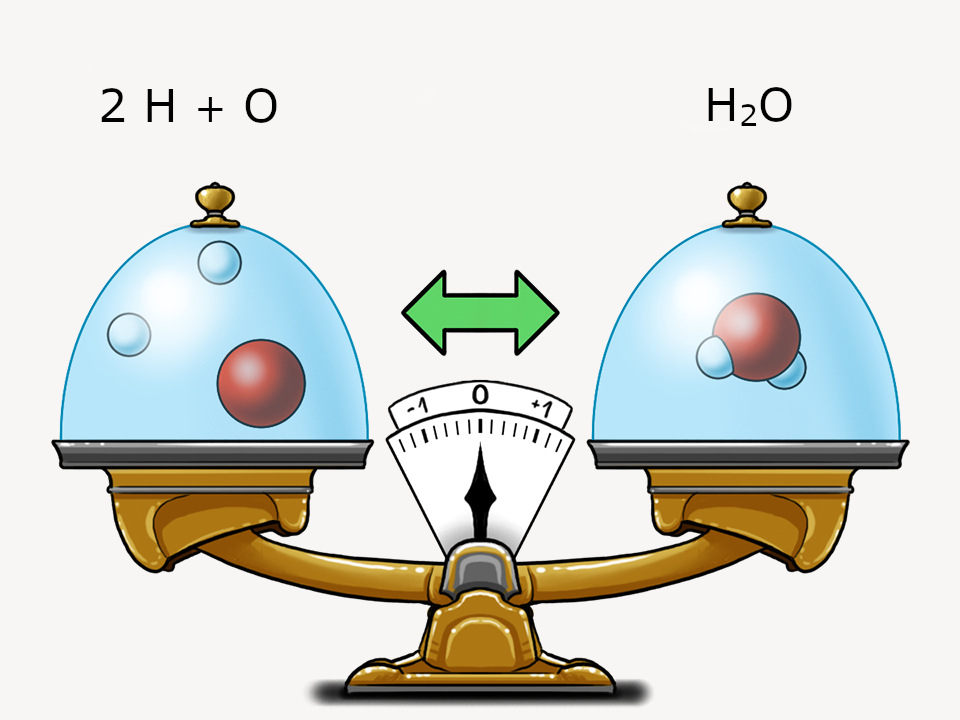
Verbrennt eine Kerze, wird das Kerzenwachs weniger. In einem offenen System verflüchtigen sich die gasförmigen Reaktionsprodukte (wie Kohlenstoffdioxid), die bei der Verbrennung entstehen.

Lerne geschlossene Systeme genauer kennen, indem du folgende Experimente durchführst!