Metallbindung
Metallgitter bestehen aus Metallkationen und frei beweglichen Elektronen (Elektronengas). Daraus ergeben sich die Eigenschaften von Metallen. Sie sind bei Raumtemperatur fest (mit Ausnahme von Quecksilber), verformbar, nicht wasserlöslich und elektrisch leitfähig.
Info für Lehrer*innen
Mehr zu SchuBu+
Grundlagen
Bei der Metallbindung werden die Außenelektronen von den Metall-Atomen freigegeben. Es bleiben positiv geladene Atomrümpfe zurück, die sich in regelmäßigen Gittern anordnen (Metallgitter). Die freigesetzten Elektronen bilden ein Elektronengas, welches aufgrund von elektrostatischen Wechselwirkungen mit den positiven Metall-Kationen (Atomrümpfen) für den Zusammenhalt des Metallgitters sorgt.
Wie werden Metalle dargestellt?
Da Metalle aus einer Atomsorte bestehen und Metallgitter aus einer Vielzahl an Metall-Kationen aufgebaut sind, werden Metalle in der Kurzschreibweise nur mit ihrem Elementsymbol dargestellt.
Dieses (z. B. Fe für Eisen) kann daher für das Element selbst, ein Atom des Elements oder den metallischen Zustand
Eigenschaften von Metallen
Fast alle Metalle liegen bei Raumtemperatur als Feststoffe vor, da sie hohe Schmelz- und Siedepunkte aufweisen.
Das Metall mit dem höchsten Schmelzpunkt bei

Quecksilber (Hg) ist das Metall mit dem geringeren Schmelzpunkt (

Metalle haben einen metallischen Glanz, sind nicht wasserlöslich und gute elektrische Leiter. Ihre Leitfähigkeit beruht auf der Beweglichkeit der Elektronen des Elektronengases. Diese Elektronen können auch Wärme transportieren, weshalb Metalle auch gute Wärmeleiter sind.
Die gute elektrische Leitfähigkeit nutzt man in der Elektrotechnik, die Wärmeleitfähigkeit beispielsweise bei Heizkörpern. Das warme Wasser im Heizkörper ist ein guter Wärmetransporter (es hat eine hohe Wärmespeicherkapazität), das Metall ist ein guter Wärmeleiter, sodass die Luft im Raum erwärmt wird (Wärmestrahlung).

Dies kannst du ganz eindrucksvoll bei Wunderkerzen (Sprühkerzen) sehen. Sie bestehen aus Eisen- und Aluminium-Pulver, aus einer Substanz, die Sauerstoff liefert, und Bindemittel. Zündet man die Wunderkerze an, reagiert Aluminium mit dem Sauerstoff und liefert damit ausreichend Energie, damit die Kerze weiterbrennt. Die versprühten Funken entstehen durch verbrennende Eisenkörnchen!

Achtung, Wunderkerzen können nicht ausgepustet werden! Aber warum? Da Sauerstoff nicht durch die Umgebung zugeführt, sondern von einer sauerstoffreichen Verbindung in der Wunderkerze geliefert wird, entstehen höhere Temperaturen als bei einer Kerzenflamme. Diese sind für die Verbrennung der Metalle notwendig – können aber mit der Atemluft nicht ausreichend abgekühlt werden!
Info für Lehrer*innen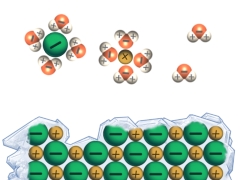
Bindungsarten und -eigenschaften
Die charakteristischen Eigenschaften von Stoffen lassen sich mit deren Strukturen begründen. Lerne hier die Bindungsarten und die Eigenschaften der verschiedenen Bindungstypen noch genauer kennen!
Unsere Körpertemperatur ist höher als die Raumtemperatur. Daher wird die Wärme der Hautoberfläche vom Metall aufgrund seiner guten Wärmeleitfähigkeit vom Körper weggeleitet. Isolierende Materialien (z. B. Holz) hingegen fühlen sich vergleichsweise warm an.
Legierungen
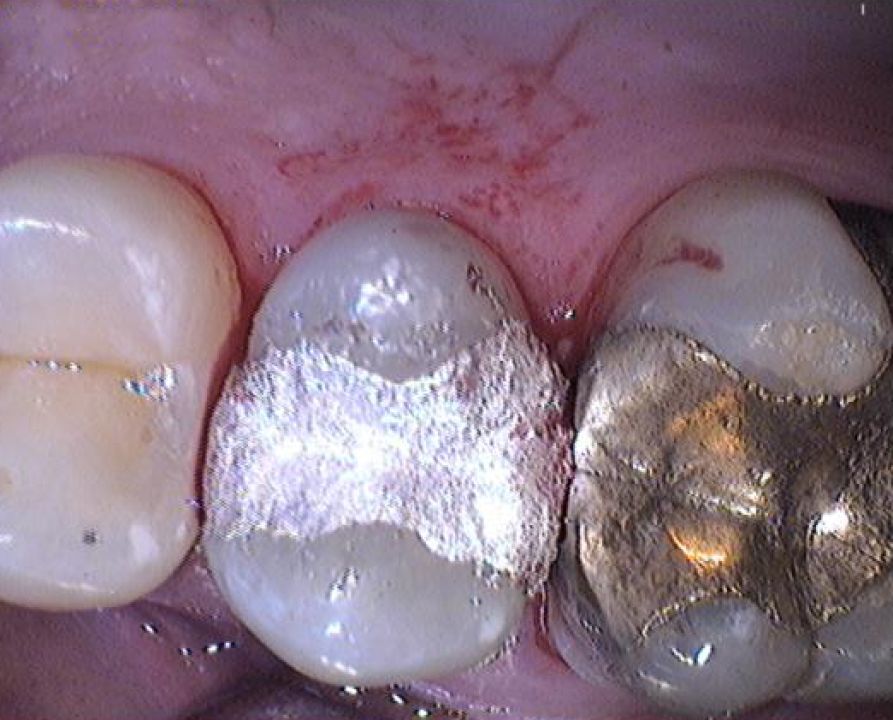
Eine Legierung ist ein homogenes Stoffgemisch aus zwei oder mehr Feststoffen, oftmals Metallen. Durch das Legieren von Stoffen können die Eigenschaften eines Werkstoffes entsprechend verändert werden. Bekannte Legierungen sind Bronze (Kupfer und Zinn), Messing (Kupfer und Zink) und Amalgam (Quecksilber mit verschiedenen Metallen wie Silber, Kupfer oder Zinn). Amalgam wurde und wird als Zahnfüllung („Plombe“) verwendet.

Eine Legierung, bei der ein Metall mit einem Nichtmetall-Feststoff vermischt wird, ist Stahl, eine Eisen-Kohlenstoff-Legierung, bei der der Kohlenstoffgehalt max.
