Reaktionsgleichungen
Die Formelsprache ermöglicht, chemische Reaktionen international verständlich und übersichtlich darzustellen. Durch Reaktionsgleichungen kann man auf einen Blick sehen, was passiert.
Info für Lehrer*innen
Mehr zu SchuBu+
Aufstellen und Ausgleichen
Bei Reaktionsgleichungen wird ähnlich wie bei Rezepten dargestellt, welche Zutaten man braucht, um ein Produkt herzustellen. Nimmt man 2 Scheiben Toastbrot und 2 Scheiben Käse, erhält man nach dem Toasten einen leckeren Käsetoast.
Im Kapitel „Was ist Chemie“ wurde erklärt, dass das Verbrennen von Magnesium eine chemische Reaktion ist. Die Reaktion des metallischen Magnesiums mit dem Luftsauerstoff wird wie folgt dargestellt:
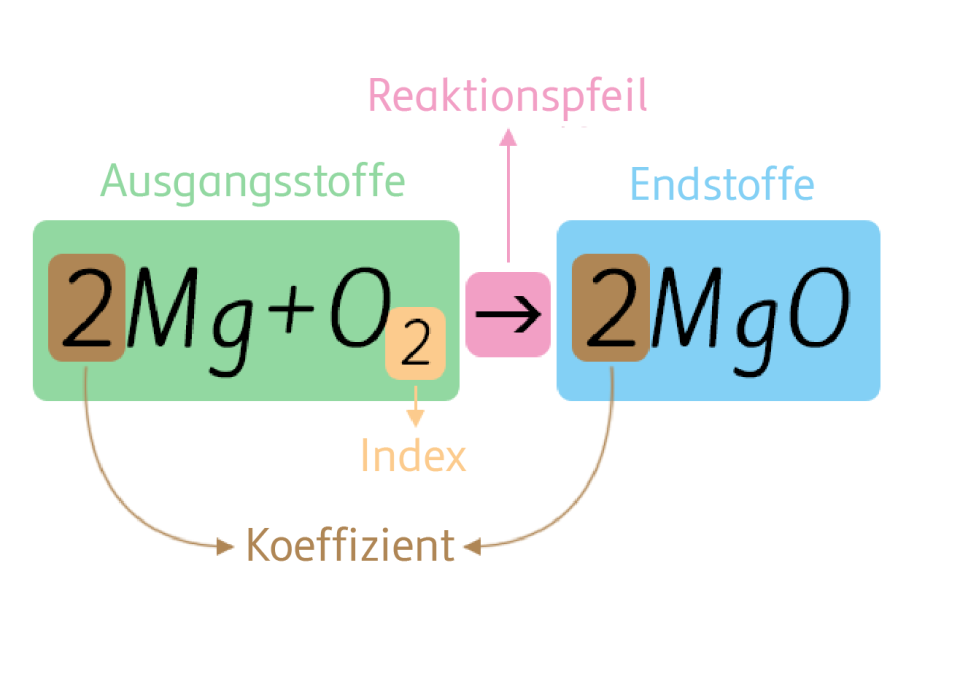
| Formelgleichung | 2 Mg | + | O2 | 2 MgO |
| Wortgleichung | Magnesium | + | Sauerstoff | Magnesiumoxid |
| Man spricht | Magnesium | reagiert mit | Sauerstoff | zu Magnesiumoxid |
Aufstellen einer Formelgleichung
Links vom Reaktionspfeil werden die Ausgangsstoffe (Edukte) angeschrieben, rechts die Endstoffe (Produkte). Für die beteiligten Substanzen verwendet man die Formelschreibweise, die bereits beim Thema Bindungen erklärt wurde.
Ausgleichen einer Formelgleichung
Es müssen links und rechts vom Reaktionspfeil gleich viele gleichartige Atome vorkommen.
Daher verwendet man Koeffizienten (Zahlen vor den Formeln), um die Reaktionsgleichungen richtigzustellen.
Beachte!
Beim Ausgleichen werden nur Koeffizienten verändert, niemals Indices in Formeln.
Ein Koeffizient bezieht sich immer auf die gesamte Formel, ein Index in einer Formel bezieht sich immer auf das Elementsymbol, hinter dem er steht.
Brauchst du noch Hilfe beim Aufstellen und Ausgleichen einer Reaktionsgleichung? Dann informiere dich hier!
Das Ausgleichen von Reaktionsgleichungen erfordert etwas Übung. Hier kann man üben und überprüfen, wie gut es schon klappt.
Reaktanden, Produkte und Reste wird von PhET, University of Colorado Boulder zur Verfügung gestellt.Aussagen einer Reaktionsgleichung
Mit einer Reaktionsgleichung kann man darstellen, welche Substanzen miteinander reagieren, und welche Stoffe dabei entstehen (qualitative Aussage).
In Formelgleichungen wird durch den Koeffizienten auch eine quantitative Aussage getroffen. Das bedeutet, dass man ablesen kann, in welchem Teilchenverhältnis die Substanzen miteinander reagieren. Beispielsweise lässt sich aus der Knallgasreaktion ablesen, dass dafür doppelt so viele Moleküle Wasserstoff wie Sauerstoff für die Reaktion benötigt werden.
Reaktionen näher beschreiben
Manchmal ist es wichtig, dass man zusätzliche Informationen in einer Reaktionsgleichung angibt.
Viele Reaktionen verlaufen nicht nur in eine Richtung. Das bedeutet, dass die Endstoffe unter bestimmten Bedingungen wieder miteinander reagieren und Ausgangsstoffe entstehen. Solche umkehrbaren (reversiblen) Reaktionen werden mit einem Doppelpfeil () dargestellt. Beispielsweise ist die Synthese von Ammoniak (NH3) eine umkehrbare Reaktion.
Man kann Aussagen über den Aggregatzustand machen oder beschreiben, dass eine Substanz in Wasser gelöst vorliegt. Dabei schreibt man tiefgestellt in runden Klammern die entsprechende Abkürzung. Diese leiten sich von englischen Begriffen ab.
| Aggregatzustand | Abkürzung | englischer Begriff | Beispiel |
|---|---|---|---|
| fest | s | solid | Zn(s) |
| flüssig | l | liquid | H2O(l) |
| gasförmig | g | gaseous | O2(g) |
| in Wasser gelöst | aq | aqueous | ZnCl2(aq) |
Weitere Möglichkeiten, zusätzliche Informationen in Reaktionsgleichungen darzustellen, werden bei folgendem Beispiel gezeigt. Bei den Ausgangsstoffen symbolisiert der Punkt, dass hier Wasser an das Kristallgitter von Kupfersulfat (CuSO4) gebunden ist. Über (oder unter) Reaktionspfeilen schreibt man Reaktionsbedingungen, wie die Zufuhr von Temperatur. Der nach oben gerichtete Pfeil zeigt, dass das Wasser als Gas frei wird.
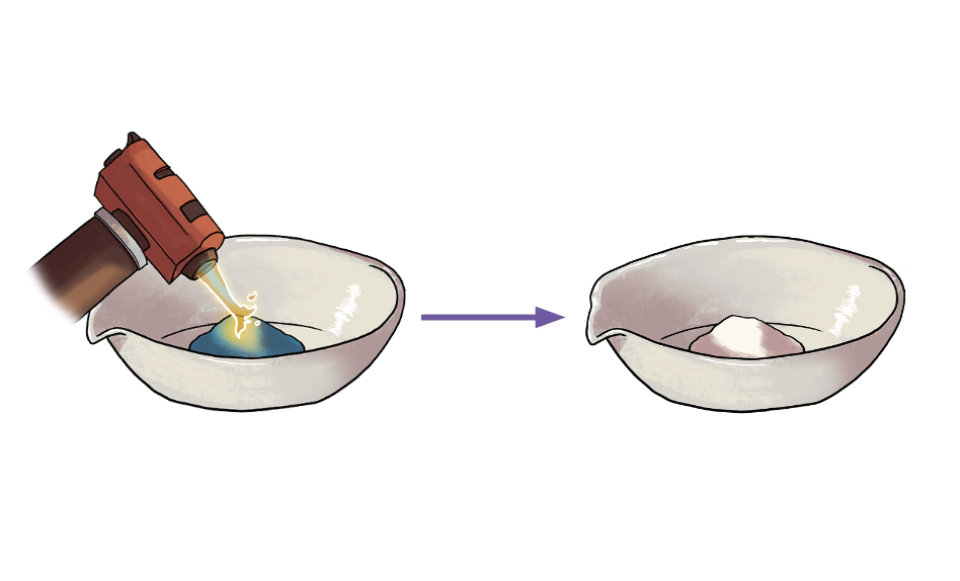
Fällt bei einer chemischen Reaktion in einer Lösung ein Feststoff aus, so spricht man von einem Niederschlag. Die entsprechende Verbindung wird mit einem gekennzeichnet.

Finde heraus, wie gut du dich schon mit Reaktionsgleichungen auskennst, indem du die Darstellungen mit den Bezeichnungen verbindest!