Mol: die Einheit der Stoffmenge
Die physikalische Größe der Stoffmenge mit dem Formelzeichen n ist eine Basisgröße im Internationalen Einheitensystem (SI). Mit Hilfe der Stoffmenge kann man ermitteln, wie viele Teilchen sich in einer vorliegenden Substanz befinden.
Info für Lehrer*innen
Mehr zu SchuBu+
Eine neue Einheit stellt sich vor
Aus einer Reaktionsgleichung kann man das vorliegende Teilchenverhältnis der beteiligten Substanzen herauslesen. Beispielsweise werden bei der Synthese von Ammoniak (NH3) dreimal so viele Moleküle Wasserstoff (H2) wie Stickstoff (N2) benötigt.
Atome sind so klein, dass man sie nicht einzeln zählen kann. Daher hat man Anfang des
| Bezeichnung | Menge |
|---|---|
| 1 Paar | 2 Stück |
| 1 Dutzend | 12 Stück |
| 1 Mol | 6,02 ∙ 10$$^{23}$$ Teilchen |
Ein Mol eines Stoffes beinhaltet 6,02 ∙ 10$$^{23}$$ Teilchen, das sind
Die physikalische Größe der Einheit mol bezeichnet man als Stoffmenge. Die Teilchenzahl für ein Mol wurde experimentell ermittelt und wird auch als Avogadro-Zahl N$$_A$$ bezeichnet.
Eine Reaktionsgleichung kann auch mit Hilfe der Stoffmenge gelesen werden. Bei chemischen Reaktionen reagieren Teilchen immer in einem bestimmten Stoffmengenverhältnis miteinander. Bei der Ammoniaksynthese reagieren …
Wie man am Beispiel der Ammoniaksynthese sieht, bezieht sich die Stoffmenge immer auf die Anzahl der vorliegenden Teilchen. Diese können unterschiedlich sein: man kann damit einzelne Atome oder Verbindungen meinen.
Gleich viele, aber nicht gleich schwer
Eine wichtige Tätigkeit, um Mengen im Labor zu bestimmen, ist das Wiegen. Deshalb wurde die Stoffmenge so festgelegt, dass es einen klaren Zusammenhang mit der Masse der vorliegenden Atome oder Verbindungen gibt. Im Periodensystem kann man die experimentell ermittelte Atommasse ablesen. Die Einheit dazu ist g/mol [Gramm pro Mol]. Da man sich dabei immer auf die gleiche Anzahl an Teilchen bezieht (pro Mol), spricht man von der molaren Masse: man vergleicht immer die gleiche Anzahl an Teilchen, die Masse ist aber unterschiedlich.
Beispielsweise wiegt 1 mol
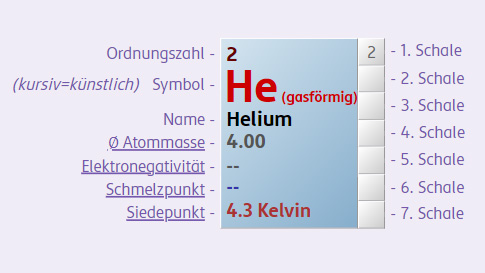
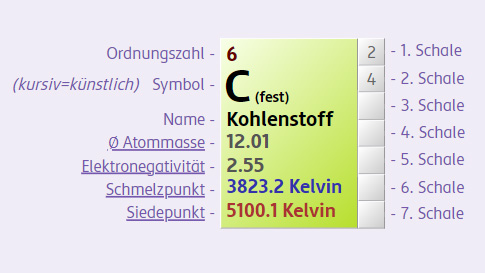
Bei jedem dieser Stoffe liegt

Mol-Waage
Bei jedem dieser Stoffe liegt 1 mol vor. Finde heraus, wie viel sie wiegen!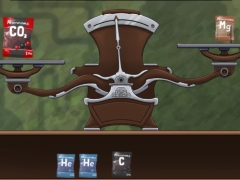
Mol-Balance
Versuche die Molpackungen links und rechts auf der Waage so auszubalancieren, dass sie gleich viel wiegen!Über die Masse lassen sich auch Rückschlüsse auf die Anzahl der beteiligten Atome ziehen. Hat man
Eine Reaktion genauer betrachten
Wenn man die Reaktionsgleichung einer Reaktion und die Stoffmenge einer beteiligten Substanz kennt, kann man Aussagen über die anderen, an der Reaktion beteiligten, Stoffe machen.
Betrachten wir dazu ein Beispiel genauer: Verbrennt man ein Magnesiumband in Kohlenstoffdioxid (CO$$_2$$), entstehen Kohlenstoff und Magnesiumoxid (MgO). Das verwendete Magnesiumband kann man vor der Reaktion abwiegen. Die dadurch bekannte Masse von Magnesium ermöglicht, dass man Aussagen zur Reaktion treffen kann.
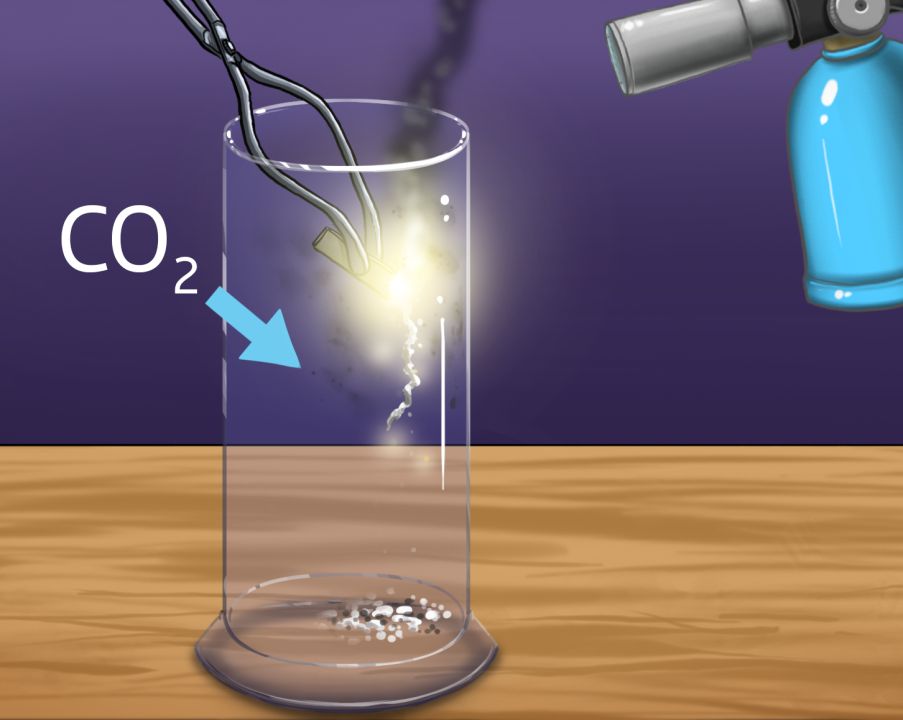
In folgende Übersicht kannst du die Masse an Magnesium eingeben. Daraus kann ermittelt werden, wie viele CO$$_2$$-Moleküle für die Reaktion benötigt werden und wie viele Teilchen bei der Reaktion entstehen.
| CO2 + | C + | 2 MgO | ||
|---|---|---|---|---|
| vorliegende Masse | 1 | 1 | 1 | |
| vorliegende Teilchen |
Beispielsweise kann man ablesen, dass bei der Reaktion doppelt so viele Teilchen Mg wie CO2 beteiligt sind. Bei der Reaktion entstehen so viele Kohlenstoff-Atome, wie CO2-Moleküle am Beginn der Reaktion vorliegen.