Gleichspannungsquellen
Galvanische Zellen und Voltasäulen stehen am Anfang der elektrochemischen Spannungserzeugung und auch Frösche spielten eine prominente Rolle. Wie diese Art der Stromerzeugung funktioniert, wie die Zelle zur Batterie wird und wie man eine Voltasäule bauen kann, wird auf dieser Seite behandelt.
Info für Lehrer*innen
Mehr zu SchuBu+
Frösche und Zufall
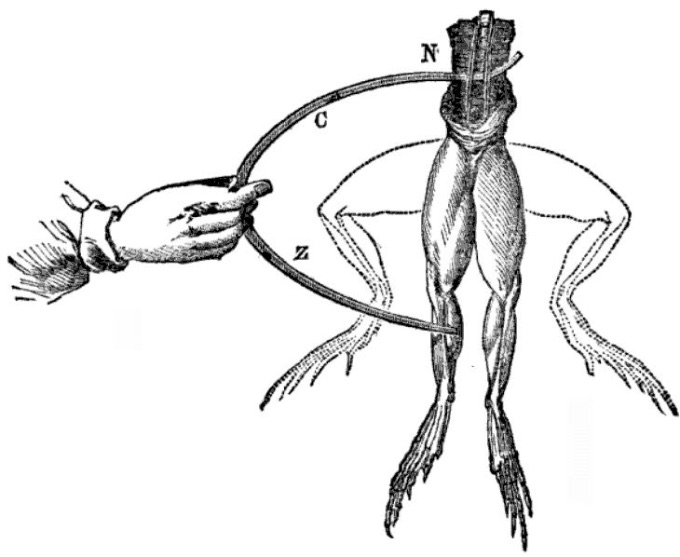
Der italienische Arzt Luigi Galvani beschäftigte sich ab 1780 mit der Nervenreizung von Tieren. Bei diesen Experimenten, an denen seine Frau Lucia Galeazzi Galvani aktiv beteiligt war, machte Lucia eine folgenreiche Zufallsentdeckung: Ein präparierter Froschschenkel zuckte immer dann zusammen, wenn an der Elektrisiermaschine im Labor ein Funken erzeugt wurde. Das Paar untersuchte dieses Phänomen weiter und stellte fest, dass Froschschenkel ebenfalls zu zucken begannen, wenn sie mit Nadeln aus Eisen und Kupfer berührt wurden, die leitend miteinander verbunden waren. Galvani nannte das Phänomen „tierische Elektrizität“ und vermutete die Quelle der Elektrizität im Muskel selbst.
An Galvani
Das holde Weib, das Dir die Macht der Liebe,
Ihr Herz besiegt mit goldnem Pfeil, verband,
Dann Tod, mit seiner Sichel grausem Hiebe,
Als Blume für des Himmels Zier entwand;
Sie war’s, nicht Du, die neue Lebenstriebe
In hautentblößter Frösche Gliedern fand,
Wenn hier der Nerven wunderbar Getriebe,
Dort funkensprüh’nden Leiter traf die Hand.
Wie flog die Treue einst Dir's zu vertrauen
Das Zauberwort auf dessen Filtig nun
Dein Name Meer und Alpen überschreitet
Jetzt blickt sie nieder auf Dein rühmlich Thun
Des Glückes froh das Deinen Schritt geleitet
wär's auch uns vergönnt sie so zu schauen
Heute wissen wir, dass die Muskeln des toten Frosches nicht der Ursprung der elektrischen Spannung in diesem Experiment waren, sondern die Spannung nur sichtbar machten. Der entscheidende Faktor waren die unterschiedlichen Metalle und die leitende Verbindung: Galvani hatte unwissentlich eine Spannungsquelle hergestellt, die aus zwei verschiedenen Metallen und einer elektrisch leitenden Flüssigkeit (Elektrolyt) bestand. Die beiden Metalle sind die Nadeln aus Eisen und Kupfer und die leitende Flüssigkeit ist das salzige Wasser im Gewebe der Froschschenkel. Der fließende elektrische Strom führte zum Zucken der Froschschenkelmuskeln.


Voltasäule
Die genauen Beobachtungen des wissenschaftlich interessierten Ehepaares und ihre gewissenhaften Aufzeichnungen waren für die weitere Entwicklung der Elektrizität sehr wichtig.
Sie ermöglichten etwa 20 Jahre später dem italienischen Physiker Alessandro Volta eine völlig neue Art von Spannungsquelle zu entwickeln: Er fand durch zahlreiche Versuche zuerst die elektrochemische Spannungsreihe der Metalle und entwickelte dann die erste funktionierende Batterie. Den zugrunde liegenden elektrochemischen Prozess nannte er Galvanismus und zeigte damit seine Anerkennung gegenüber den wertvollen Vorarbeiten.

Volta baute schließlich Türme aus mehreren galvanischen Elementen übereinander. Die einzelnen Elemente bestanden zum Beispiel aus einer Kupferplatte, einer saugfähigen Scheibe (Leder, Filz, Karton), die mit Säure oder Salzwasser getränkt war, und einer Zinkplatte. Die Abbildung zeigt eine solche Säule aus 16 galvanischen Elementen. Diese Erfindung war die erste brauchbare kontinuierliche Spannungsquelle und hat die Erforschung der Elektrizität stark vorangetrieben. Deshalb wurde im 19. Jahrhundert die Einheit der Spannung Volta zu Ehren Volt genannt.

Durch seine Forschungen wusste Volta bereits, dass die Spannung der einzelnen galvanischen Elemente von der Kombination der Metalle abhing: Besonders hohe Spannungen ergaben sich bei der Kombination von edlen mit sehr unedlen Metallen.
Voltas Labor
Positioniere die einzelnen Elemente so aufeinander, dass eine möglichst große Spannung entsteht. Ein paar hilfreiche Hinweise sind im Labor versteckt.
Galvanische Zellen heute
In den Anfängen der elektrochemischen Spannungserzeugung war den Wissenschaftlerinnen und Wissenschaftlern noch nicht klar, dass sich diese Batterien „verbrauchen“ und nicht ewig halten. Das ist heute jedem klar und liegt an den unterschiedlichen elektrochemischen Vorgängen in den Zellen.
Je nach Chemie unterscheidet man zwischen Primärzellen („Batterien“), Sekundärzellen (Akkumulatoren, „Akkus“) und Tertiärzellen (Brennstoffzellen). Alle galvanischen Zellen wandeln chemische Energie in elektrische Energie um.
Primärzellen
Viele „Batterien“, die heute bei uns im Handel erhältlich sind, sind sogenannte Alkali-Mangan-Zellen.
Diese Zellen sind schon etwas komplizierter aufgebaut als die galvanischen Zellen der Voltasäule.
Statt Zinkblech wird hier ein Zinkpulvergel verwendet und Kupfer wurde durch Braunstein (Manganoxid, verhindert Gasbildung) ersetzt, das direkt die Blechhülle berührt, die zugleich der Pluspol der Zelle ist.
Der Minuspol ist das Zinkgel.
Mittels Ableitnagel wird der Kontakt zum Minuspol der Zelle hergestellt.
Die Nennspannung der Zelle beträgt

Die meisten „Knopfzellen“ sind Lithium-Mangandioxid-Zellen.
Hier besteht die Anode aus metallischem Lithium und die Kathode aus Mangandioxid.
Als Elektrolyt dient die Lösung eines Lithiumsalzes.
Die Nennspannung beträgt
Typisch für alle Primärzellen ist, dass sie gleich nach dem Aufbau aufgeladen sind und nur einmal entladen werden können. Ist die Reaktion in der Zelle vollständig abgelaufen, kann die Zelle auch nicht mehr elektrisch aufgeladen werden.
Sekundärzellen
Sekundärzellen haben umkehrbare chemische Prozesse und können nach der Entladung wieder aufgeladen werden.

Der Bleiakkumulator („Autobatterie“) im Auto ist eine solche Sekundärzelle.
Hier bestehen die Elektroden im geladenen Zustand aus Blei und Bleidioxid, und der Elektrolyt aus verdünnter Schwefelsäure.
Im entladenen Zustand bestehen beide Pole aus Bleisulfat.
Die Nennspannung beträgt
Im Auto wird der Bleiakku als Starterbatterie eingesetzt und während der Fahrt wieder aufgeladen. Auch der Akku in deinem Smartphone oder Tablet ist eine Sekundärzelle, allerdings mit anderem Innenleben.
Tertiärzellen
Als Tertiärzellen werden Brennstoffzellen bezeichnet. Bei dieser Art der galvanischen Zelle wird der Träger der chemischen Energie (Wasserstoff, Methanol, Ethanol, ...) kontinuierlich von außen zugeführt. Dadurch wird (zumindest in der Theorie) ein zeitlich unbeschränkter Betrieb möglich.
Fahrzeuge mit Wasserstoff-Brennstoffzellen sind neben den Elektrofahrzeugen ein Hoffnungsträger zur Bewältigung der Klimakrise. Das kann aber nur funktionieren, wenn der benötigte Wasserstoff auch CO2-neutral hergestellt wurde.
Batterien, Schaltungen galvanischer Zellen
Beim Bau der Voltasäule, bei der selbstgemachten
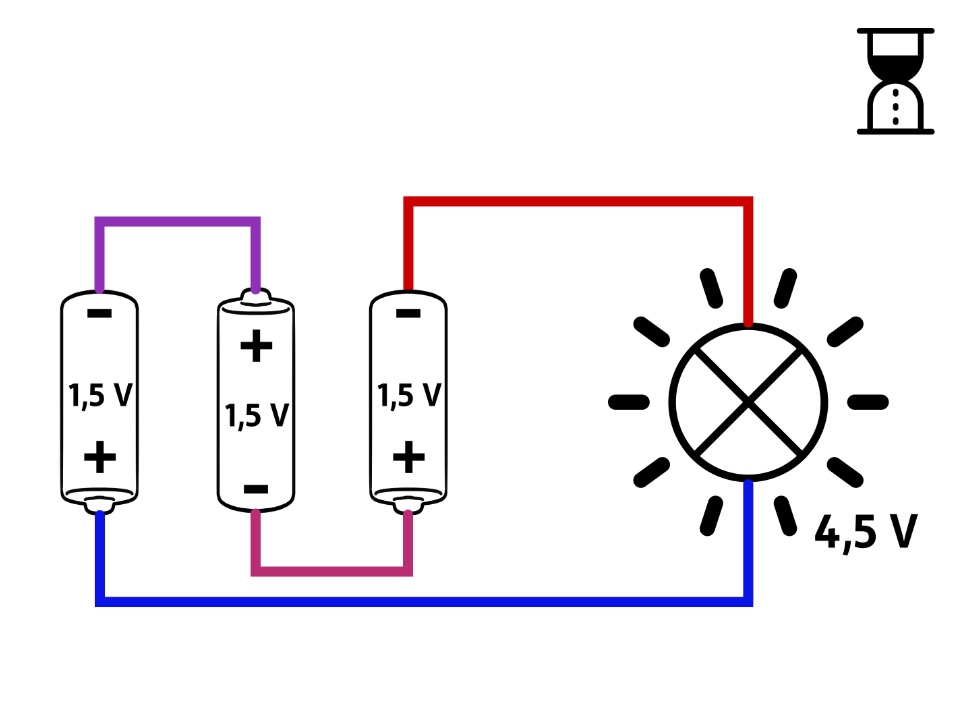
Serielle Schaltung für höhere Spannung
Oft brauchen Batteriebetriebene elektrische Geräte mehr als

Parallele Schaltung für größere Stromstärke oder längere Lebensdauer
Hier fließen die Elektronen immer nur durch eine der Zellen.
Die Spannung bleibt daher bei
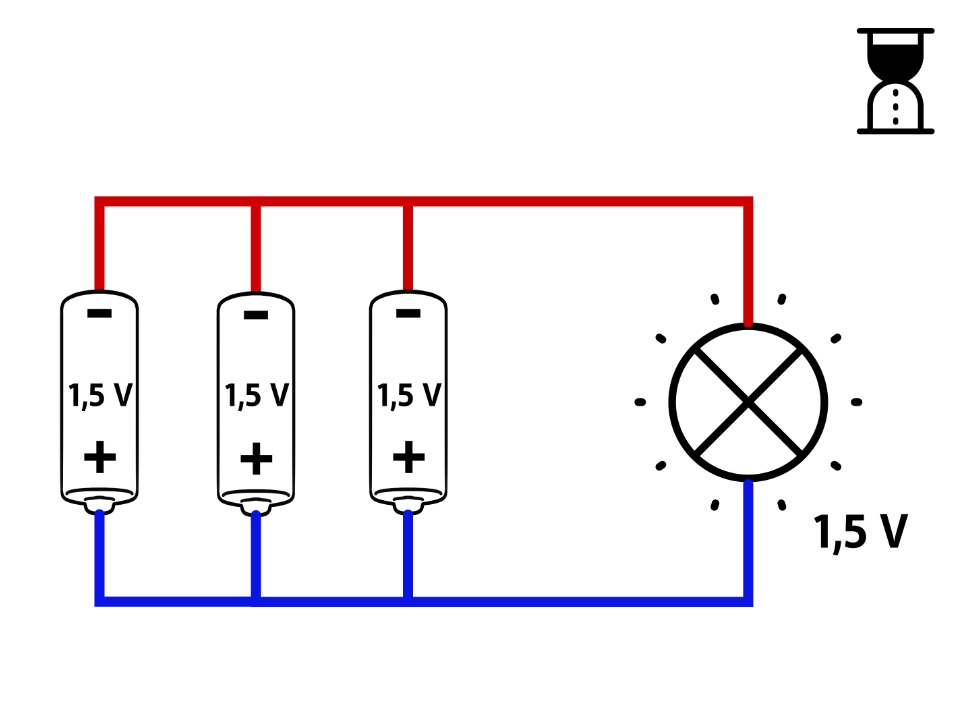
Da hier mehr chemische Energieträger zur Verfügung stehen als bei nur einer Zelle, können Elektrogeräte länger betrieben werden. Die parallele Schaltung von Spannungsquellen erlaubt auch eine höhere Intensität des Stromflusses (höhere Stromstärken).

Wie viel Spannung benötigt dieses Elektrogerät?
Diese Gerät benötigt