Stoffgruppen
Chemische Verbindungen fasst man nach ihren Eigenschaften und ihrer gemeinsamen Grundstruktur zusammen. Der Teil der Struktur, der eine Stoffklasse bestimmt, heißt funktionelle Gruppe (z. B. die OH-Gruppe der Alkohole).
Info für Lehrer*innen
Mehr zu SchuBu+
Kohlenwasserstoffe
Kohlenwasserstoffe sind Energieträger (


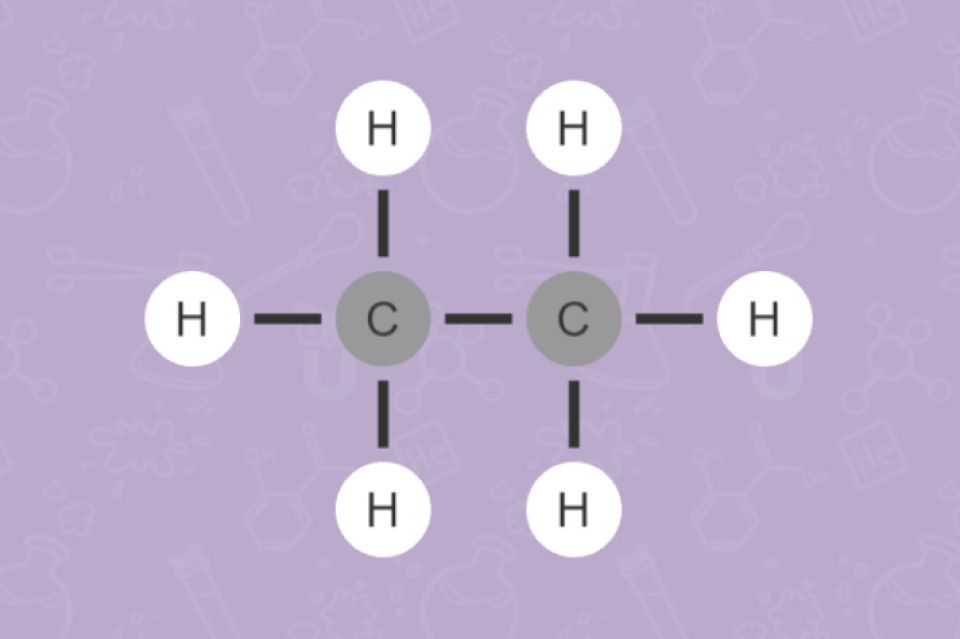
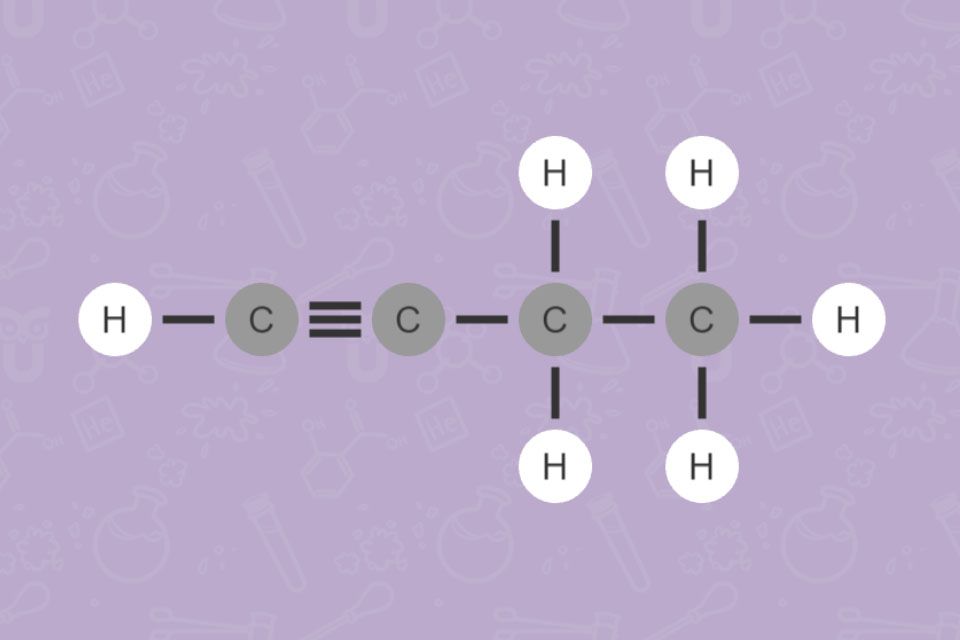
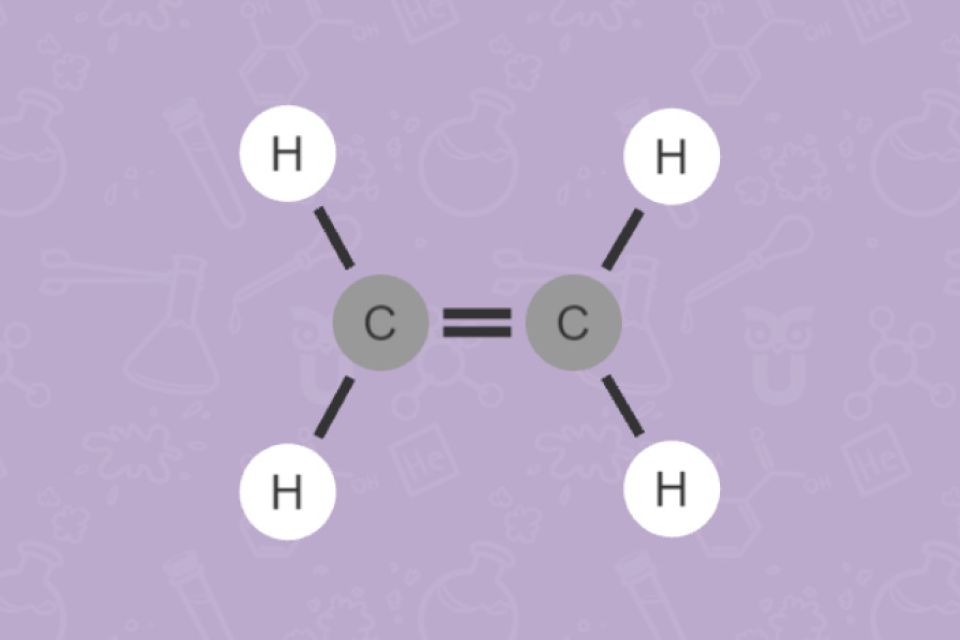
Kohlenwasserstoffe bestehen aus den Elementen Kohlenstoff und Wasserstoff. Man kann die Kohlenwasserstoffe aufgrund ihrer Struktur in Alkane, Alkene, Alkine und Aromaten einteilen. Bei Alkanen liegen nur Einfachbindungen vor, man bezeichnet sie daher als gesättigt. Alkene und Alkine haben Mehrfachbindungen. Hier spricht man von ungesättigten Verbindungen.
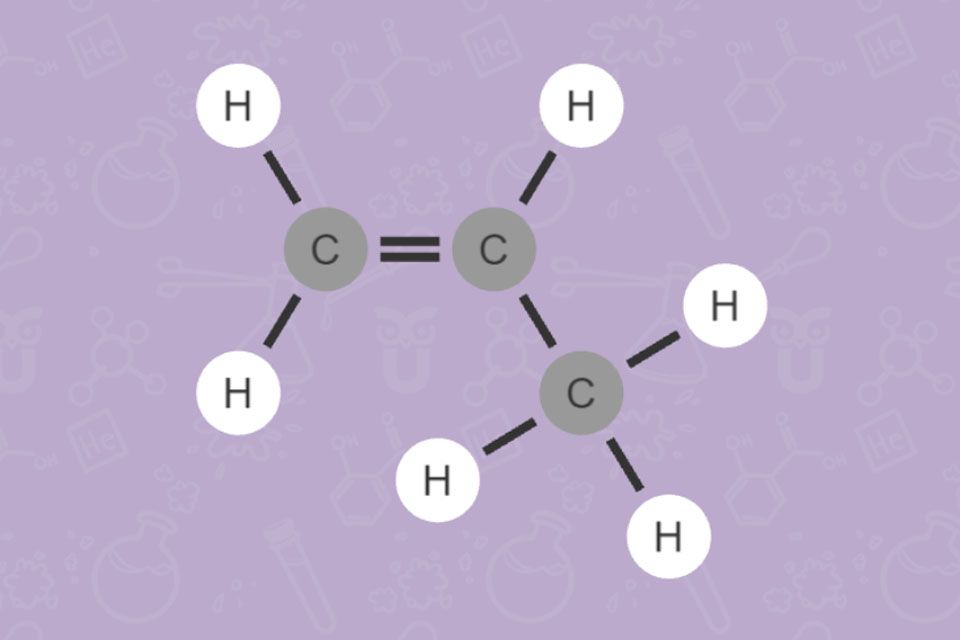
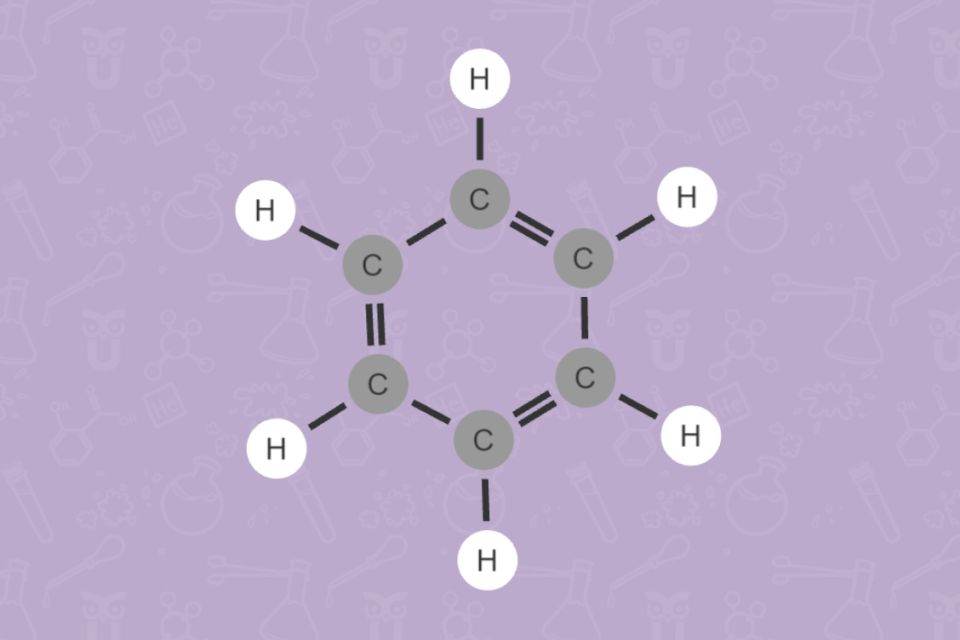
Aromaten haben eine besondere Ringstruktur. Durch diese sind sie besonders stabil. Wie ihr Name verrät, haben Aromaten oft einen auffälligen Geruch. Der bekannteste Vertreter Benzen, ist giftig und krebserregend. Von Benzen abgeleitete Verbindungen hingegen findet man in Aromastoffen (

Kohlenwasserstoffe wie Methan im Erdgas, Butan/Propan im Gaskocher und Paraffin (Gemisch aus gesättigten Kohlenwasserstoffen) im Kerzenwachs sind gängige Brennstoffe. Bei der vollständigen Verbrennung entstehen Kohlenstoffdioxid und Wasserdampf.
Beispiel Methan:
| CH4 | + | 2 O2 | CO2 | + | 2 H2O | |
| Methan | + | Sauerstoff | Kohlenstoffdioxid | + | Wasser |
Bei der Verbrennung entsteht Wasserdampf. Man kann ihn sichtbar machen, indem man ein Becherglas über eine Kerzenflamme hält: das Glas beschlägt.
Nomenklatur
Damit man die Struktur eindeutig benennen kann, hat man international gültige Benennungsregeln festgelegt. Der Wortstamm bezieht sich auf die Anzahl der vorliegenden Kohlenstoff-Atome. Beispielsweise steht die Bezeichnung Eth- für 2 C-Atome.
| Wortstamm | Anzahl der C-Atome |
|---|---|
| Meth- | 1 |
| Eth- | 2 |
| Prop- | 3 |
| But- | 4 |
| Pent- | 5 |
| Hex- | 6 |
| Hept- | 7 |
| Oct- | 8 |
Die Endung im Namen bezieht sich auf die vorliegende Gruppe, zum Beispiel -an für ein Alkan, -en für ein Alken und -in für ein Alkin.

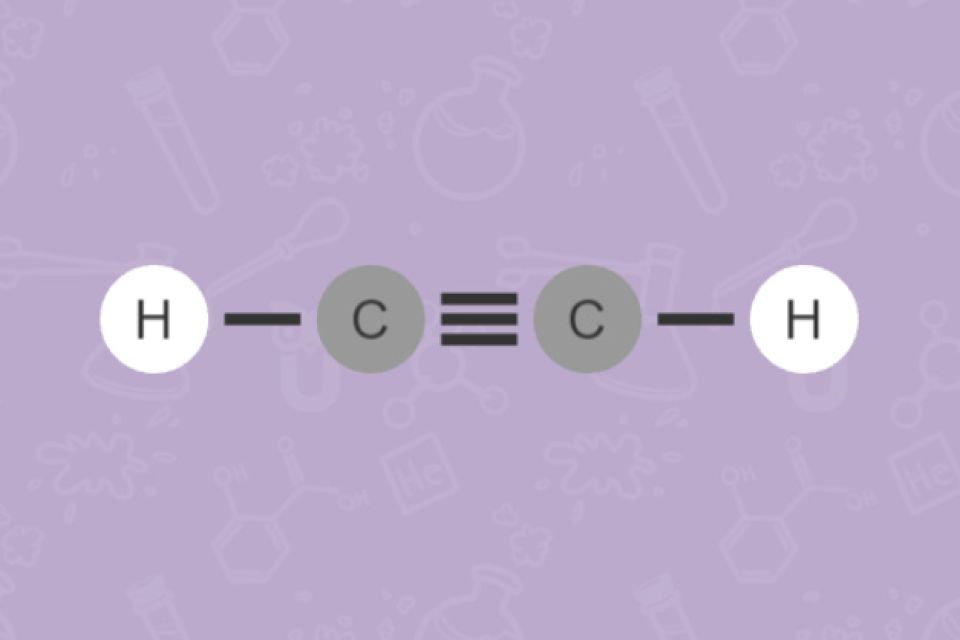
Bei Doppel- und Dreifachbindungen gibt man zusätzlich die Lage der Mehrfachbindung mit der entsprechenden Zahl an
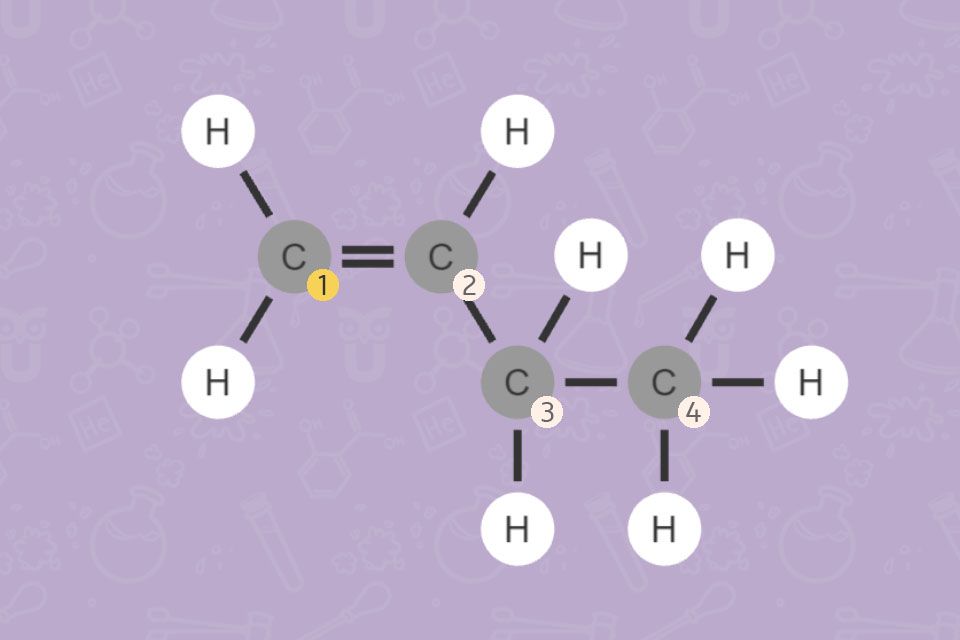
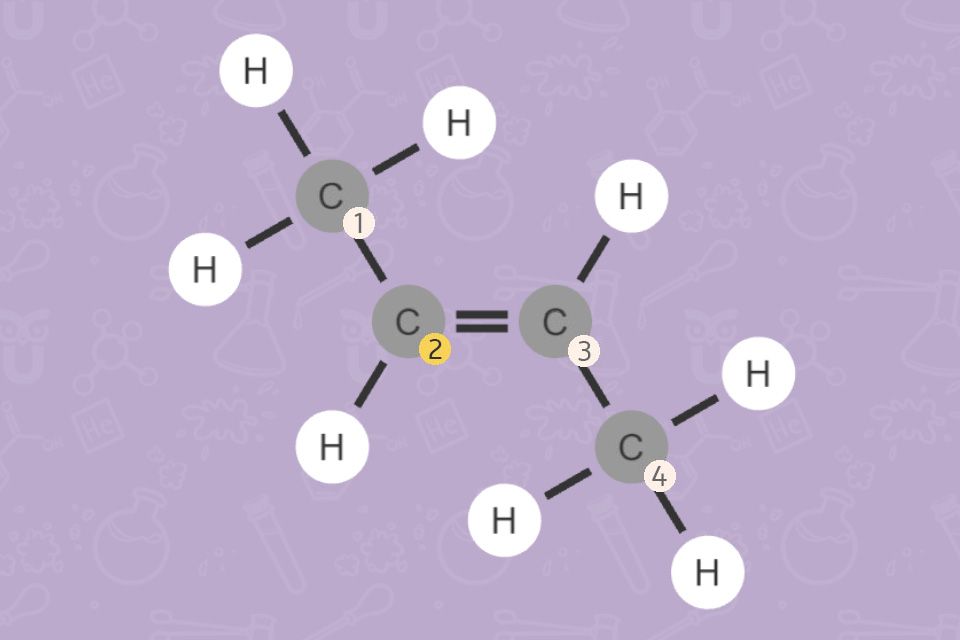
Man kann also vom Namen sofort auf die Struktur schließen (und umgekehrt).
Du kannst es selbst ausprobieren. Baue deine eigene Struktur-Kreatur aus Kohlenstoff- und Wasserstoff-Atomen!

Struktur-Kreatur
Baue deine eigene Struktur-Kreatur aus Kohlenstoff- und Wasserstoff-Atomen!Strukturisomere
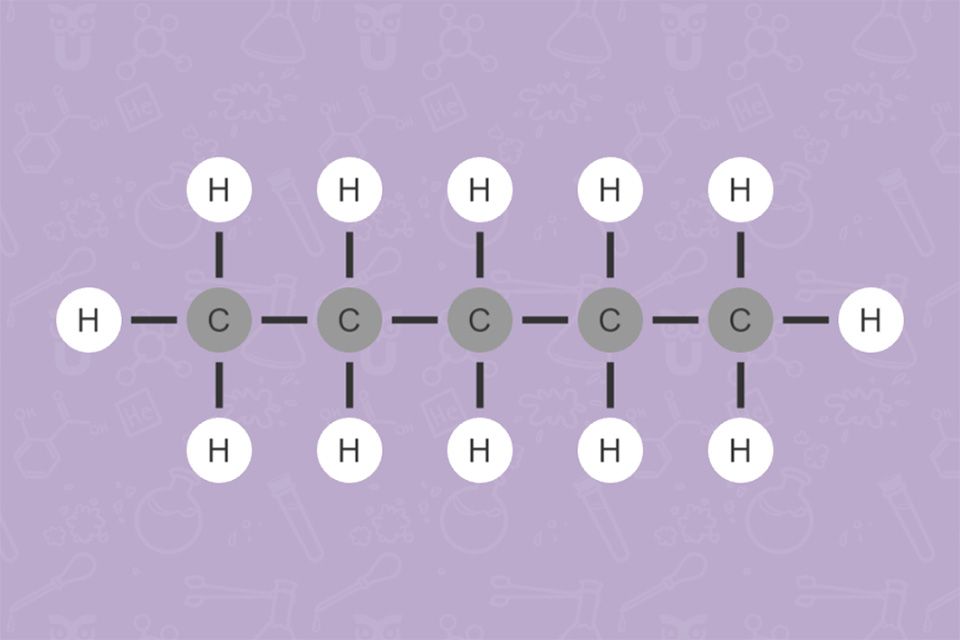
Je länger die Kohlenwasserstoff-Kette ist, desto mehr Kombinationsmöglichkeiten der vorliegenden Atome gibt es. Daher ist es wichtig, sie ganz genau zu benennen. Es gibt zum Beispiel bei einem Alkan mit 5 C-Atomen 3 Isomere.
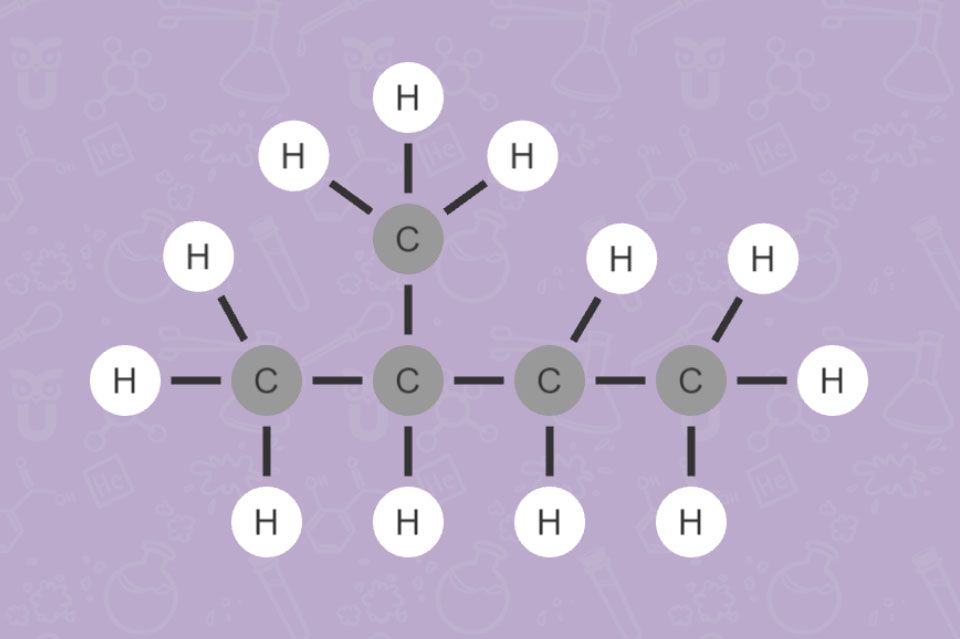
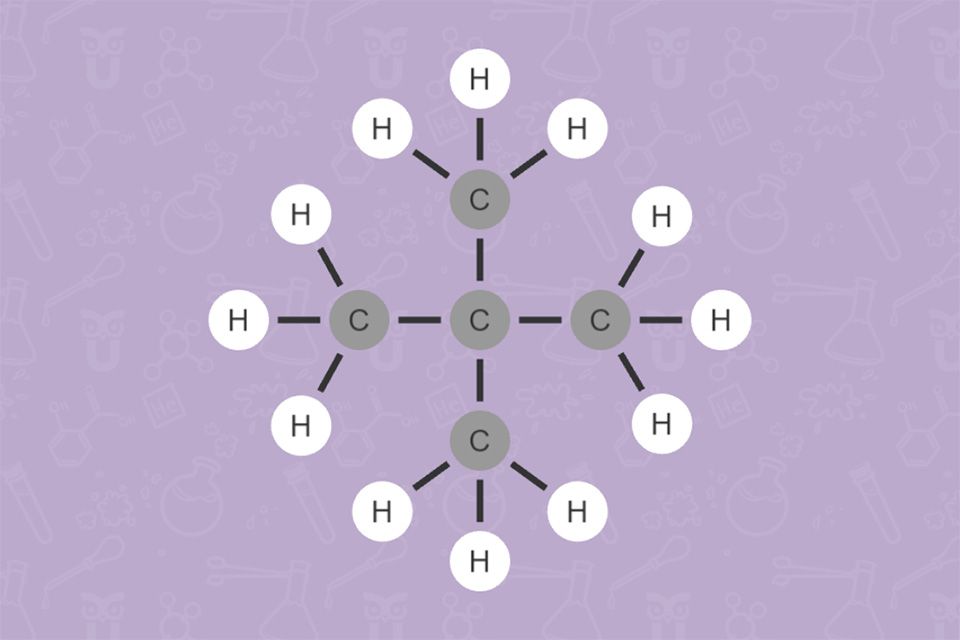
Die Abbildungen 15 und 16 zeigen verzweigte Alkane. Überlege, wofür bei deren Benennung die Zahlen und die Bezeichnungen „Methyl-“ und „Dimethyl-“ stehen!
Die Zahlen geben die Position der Seitenketten an. „Methyl-“ bezeichnet eine Seitenkette mit einem C-Atom (Wortstamm „Meth-“ für 1 C-Atom, -yl für eine Seitenkette). „Di-“ ist eine Vorsilbe, die auf 2 gleiche Seitenketten hinweist.
Bei längeren Kohlenwasserstoffketten gibt es eine viele Kombinationsmöglichkeiten. Dazu kannst du Kettenlängen von Alkanen mit bis zu 40 C-Atomen eingeben.
| Anzahl der |
Anzahl der Isomere |
|---|---|
| 1 |
Eigenschaften
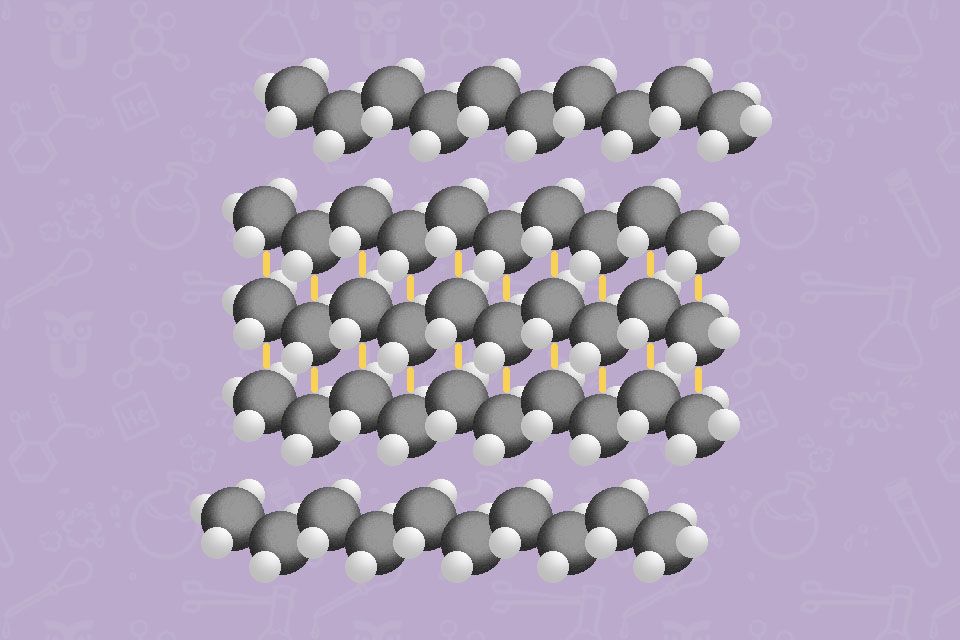
Der Siedepunkt der Kohlenwasserstoffe steigt mit der Anzahl der C-Atome. Alkane bis Butan sind gasförmig. Ab 17 Kohlenstoff-Atomen sind Alkane fest. Sie bestehen aus unpolaren Bindungen und sind daher gute Lösungsmittel für unpolare Strukturen
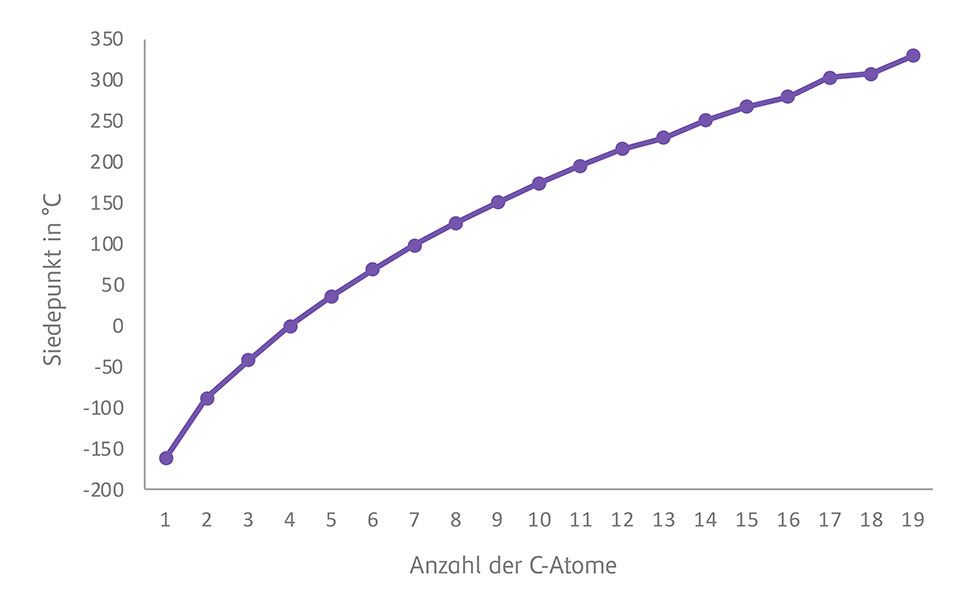
Überlege, welchen Einfluss die Struktur auf den Schmelzpunkt längerkettiger Kohlenwasserstoffe hat! Vergleiche dabei verzweigte und unverzweigte Strukturen!
Ist die Struktur verzweigt, haben die Moleküle weniger Berührungsflächen. Daher finden weniger Wechselwirkungen zwischen den Molekülen statt. Es ist weniger Energie notwendig, um die vorliegende Substanz zu schmelzen, das führt zu niedrigeren Schmelzpunkten.
Alkohole
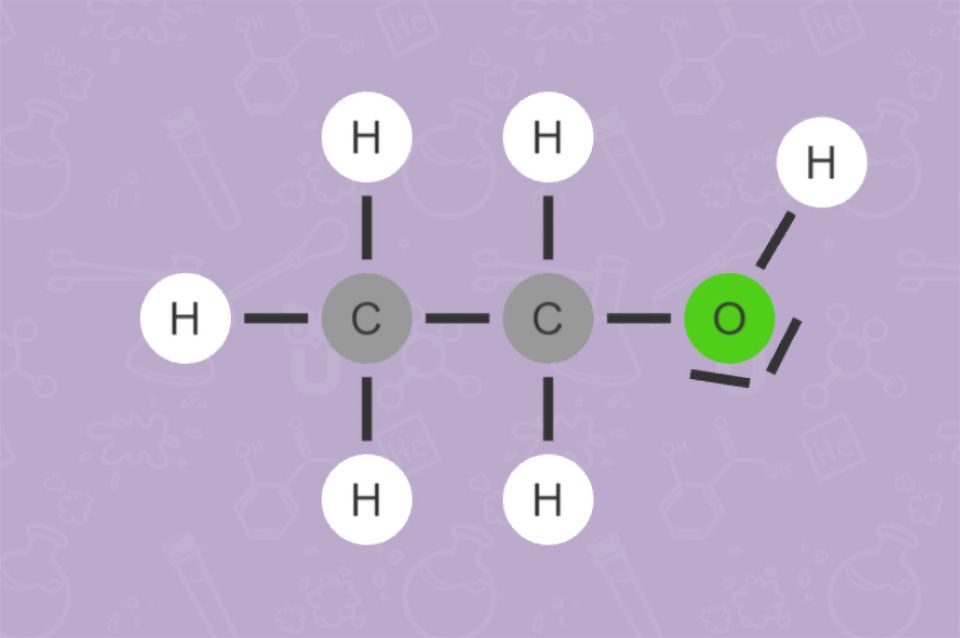
Alkohol tragen mindestens eine OH-Gruppe (Hydroxy-Gruppe). Die Namen aller Alkohole enden auf -ol. Der bekannteste Alkohol ist der Trinkalkohol Ethanol (C2H5OH). Für alkoholische Getränke wird Ethanol durch Gärung mithilfe von Hefe erzeugt.

Unter Gärung versteht man den anaeroben Abbau von organischen Stoffen (
| Alkoholische Gärung | ||||||
|---|---|---|---|---|---|---|
| C6H12O6 | 2 C2H5OH | + | 2 CO2 | |||
| Trauben- oder Fruchtzucker |
Ethanol | Kohlenstoff- dioxid |
||||
Wein wird aus Weintrauben hergestellt. Auf den Schalen der Weintrauben befindet sich die Hefe. Sie wandelt den Zucker in den Weintrauben zu Ethanol und Kohlenstoffdioxid um. Bei der Bierproduktion wird die Hefe einem Gemisch aus Wasser, Hopfen und Malz zugesetzt. Zur Herstellung hochprozentiger alkoholischer Getränke (Destillate) wird die Destillation eingesetzt.




Ethanol wird in vielen anderen Bereichen eingesetzt. Es dient als Rohstoff in der chemischen Industrie, als Kraftstoff, als Konservierungsmittel, als Reinigungsmittel und als Lösungsmittel (

Industriealkohol entsteht nicht durch Gärung. Mit Schwefelsäure als Katalysator wird er durch die Reaktion von Ethen mit Wasser hergestellt.
Überlege, welche physikalischen Eigenschaften Ethanol aufweist!
Ethanol verbrennt mit einer bläulichen Flamme. Dabei entstehen Wasser und Kohlenstoffdioxid. Ethanol
hat einen Siedepunkt von
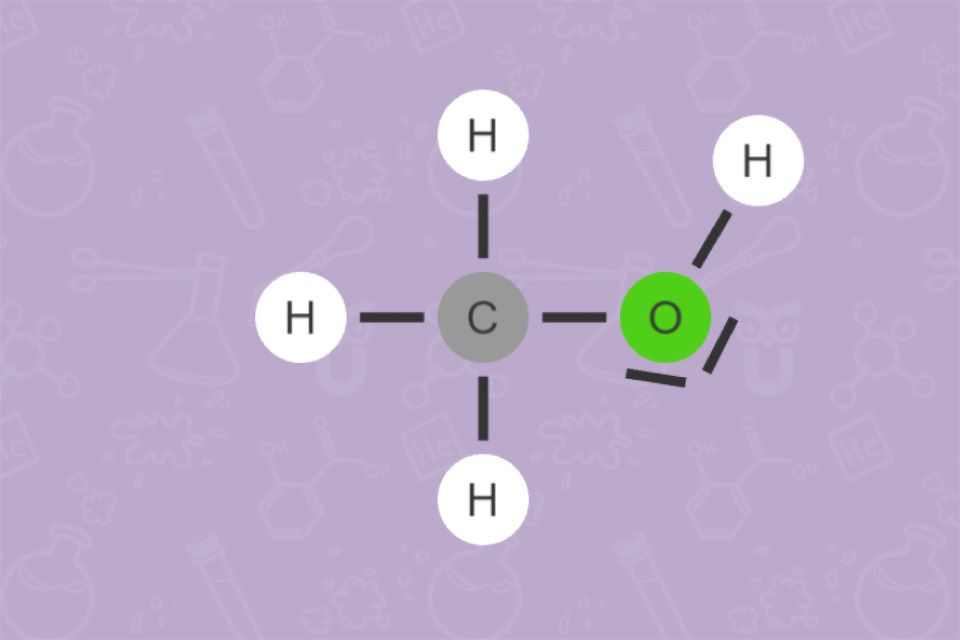
Außer Ethanol gibt es auch noch viele andere organische Verbindungen, die eine OH-Gruppe tragen und daher zu den Alkoholen zählen. Methanol dient zum Beispiel als Frostschutzmittel, als Kraftstoff und zur Gewinnung von Biodiesel. Glycerol (Glycerin) ist ein Beispiel für einen mehrwertigen Alkohol. Es ist ein Baustein unserer Nahrungsfette (Triglyceride). Glycerol bindet Feuchtigkeit. Daher verwendet es die Kosmetikindustrie als Feuchtigkeitsspender. In der Lebensmittelindustrie dient es als Feuchthaltemittel.
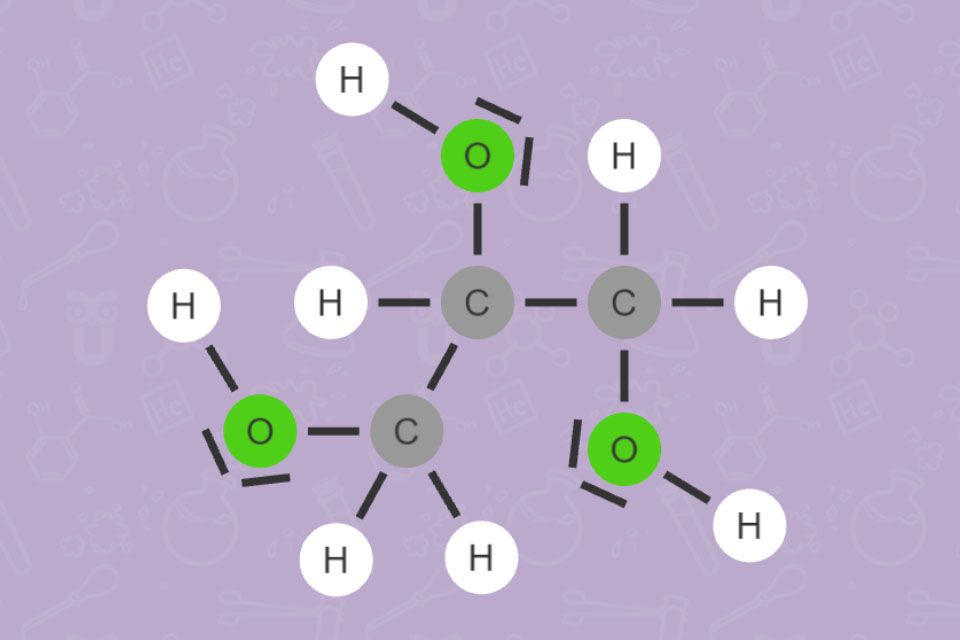

Carbonsäuren
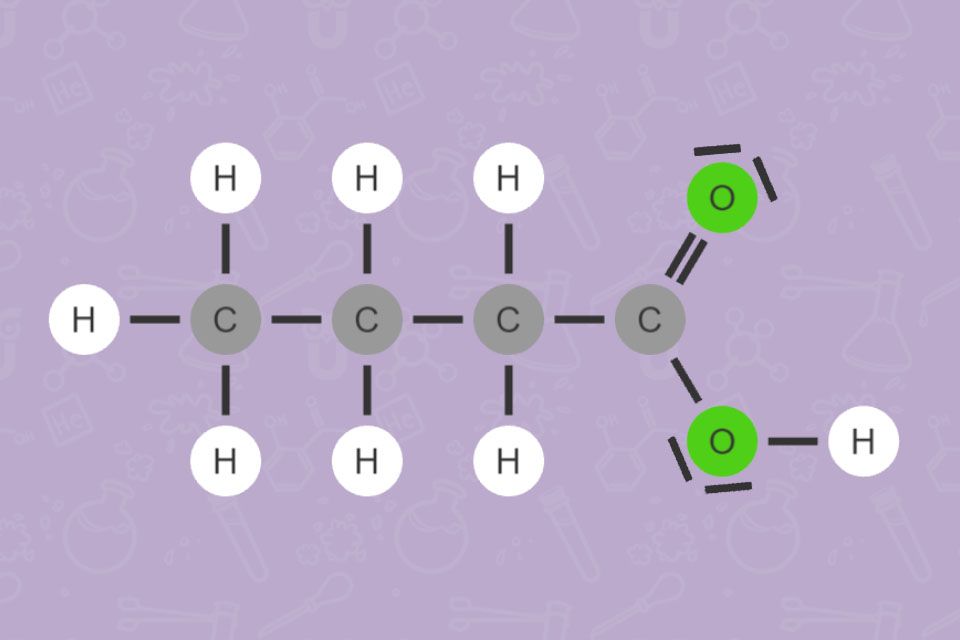
Alle Carbonsäuren haben gemeinsam, dass sie mindestens eine COOH-Gruppe
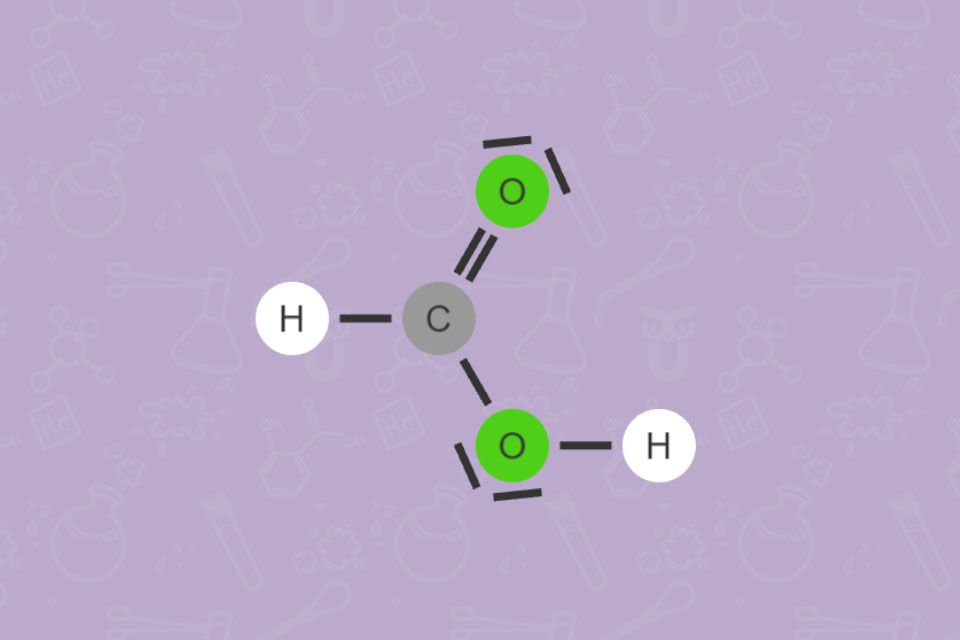
Die einfachste Carbonsäure ist Ameisensäure (Methansäure). Manche Ameisenarten sondern sie zur Verteidigung ab. Fettsäuren bauen unsere Nahrungsfette auf und sind ein wichtiger Bestandteil der Nahrung.



Essigsäure (Ethansäure) macht den Essig sauer und lange haltbar. Deshalb dient Essig schon seit der Antike als Säuerungsmittel und Konservierungsmittel.
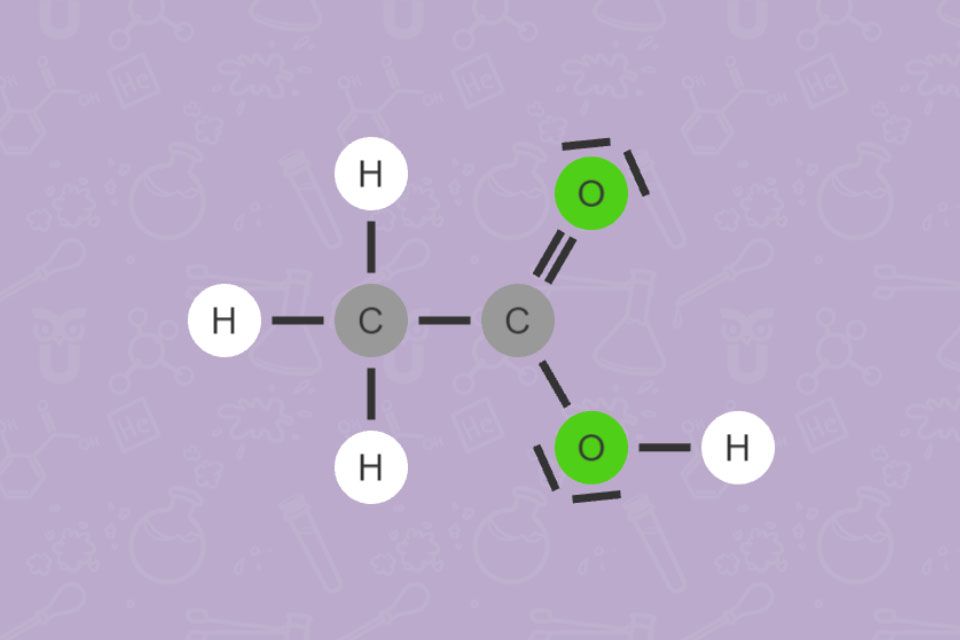
Bei der Herstellung von Speiseessig wird Ethanol durch Bakterien (Acetobacter) bei der Reaktion mit Sauerstoff oxidiert. Dabei entstehen Essigsäure und Wasser.
| Essigsäuregärung zur Herstellung von Speiseessig | ||||||
|---|---|---|---|---|---|---|
| C2H5OH | + | O2 | CH3COOH | + | H2O | |
| Ethanol | Sauerstoff | Essigsäure | Wasser | |||
Für die industrielle Produktion wird Essigsäure aus der Reaktion von Methanol mit Kohlenstoffmonoxid gewonnen. Essigsäure wird zum Beispiel in der Kunststoffherstellung, in der Medizin und in der Fotografie eingesetzt.

| Großtechnische Produktion von Essigsäure | ||||
|---|---|---|---|---|
| CH3OH | + | CO | CH3COOH | |
| Methanol | Kohlenstoff- monoxid |
Essigsäure | ||
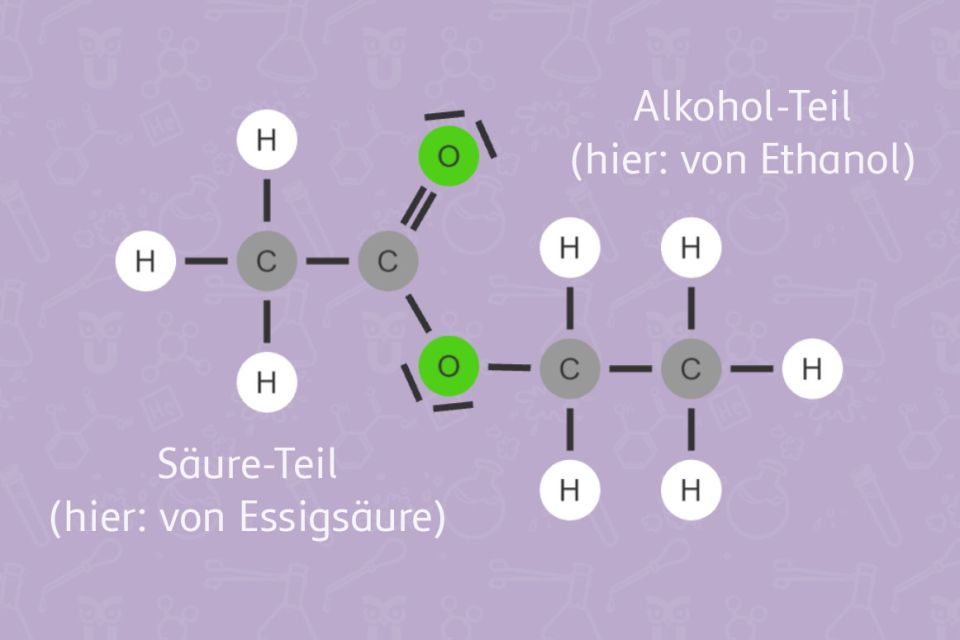
Buttersäure (Butansäure) ist für den Geruch von Erbrochenem und ranziger Butter verantwortlich. Sie kommt auch im Schweiß vor. Umso überraschender ist es, dass man durch die Reaktion von Buttersäure mit Ethanol einen Aromastoff herstellen kann, der nach Ananas riecht. Die dabei entstehende Stoffklasse nennt man Ester. Viele Carbonsäureester haben einen aromatischen, meist fruchtigen Geruch. Industriell hergestellte Ester werden daher in der Lebensmittelindustrie unter anderem als Aromastoffe benutzt.