Sauberkeit und Hygiene dank Chemie
In jedem Haushalt gibt es eine Vielzahl an Reinigungsmitteln: zum Säubern von Oberflächen und Gegenständen, zum Waschen und Pflegen von Wäsche und zur Körperhygiene. Bei der Herstellung und Anwendung muss auf die Umweltverträglichkeit der Substanzen geachtet werden.
Info für Lehrer*innen
Mehr zu SchuBu+
Reinigungsmittel im Alltag
Täglich benutzen wir Reinigungsmittel für unsere Körperhygiene: Seife, Duschgel, Shampoo und Zahnpasta. Für die Reinigung von Kleidung, Geschirr und Wohnraum setzen wir eine Vielzahl an Substanzen ein: Waschmittel, Geschirrspülmittel, Scheuermittel, Allzweckreiniger, Glasreiniger, Badreiniger und Entkalker sind Beispiele dafür.


Wie gut kennst du dich mit Reinigungsmitteln aus? Beurteile folgende Aussagen!



Seifen
Seifen sind Salze von Fettsäuren. Sie entstehen, wenn Fette mit Basen (wie Natronlauge) zur Reaktion gebracht werden (z. B. durch Kochen). Glycerol wird dabei von einem Triglycerid abgespalten. Die vorliegenden freien Fettsäuren verbinden sich mit den Metall-Kationen. Glycerol bleibt als Nebenprodukt übrig.
Verwendet man als Base Natriumhydroxid (NaOH), entstehen feste Kernseifen. Sie werden häufig zur Entfernung von Flecken eingesetzt. Feinseifen dienen der Körperpflege und werden aus geruchsfreien Kernseifen hergestellt. Dabei verwendet man pflegende Zusatzstoffe, Duftstoffe und Farbstoffe. Wird Kalilauge (KOH) eingesetzt, stellt man weiche Schmierseifen her. Sie werden als Putzmittel im Haushalt eingesetzt.


Tenside
Seifen ermöglichen, dass zwei nicht mischbare Substanzen wie Wasser und Öl in einem fein verteilten Gemisch (einer Emulsion) vorliegen können. Die in Seifen vorliegenden Fettsäure-Anionen haben einen hydrophilen und einen hydrophoben (und damit lipophilen) Teil. Daher kann es sich an Wasser und an Fett anlagern.
Substanzen, wie die Fettsäure-Anionen in Seifen, die Wasser-Öl-Mischungen emulgieren und die Oberflächenspannung herabsetzen, bezeichnet man als Tenside (Detergentien). Sie ermöglichen, dass Textilien besser benetzt werden können und sich Schmutz löst. Durch ihren lipophilen Teil werden hydrophobe Verschmutzungen wie Öle entfernt.
Aufgrund der breiten Produktpalette an Reinigungsmitteln (z. B. Flüssigseifen, Waschmittel, Duschgels, Haarshampoos, Geschirrspülmittel) und den damit verbundenen Anforderungen hat man weitere Tenside, neben Seifen, entwickelt.
Heute gibt es am Markt viele seifenfreie Reinigungsmittel, die dem Bedarf angepasst sind.


Waschmittel
Waschmittel sind flüssige, gelartige oder pulverförmige Reinigungsmittel zum Waschen von Textilien. Dabei soll die Wäsche nicht nur sauber werden, sondern auch ihre Farbe behalten, sich nach dem Waschen angenehm anfühlen und gut riechen. Weiters soll die Funktionsfähigkeit der Waschmaschine erhalten bleiben. Um diese Aufgaben zu erfüllen, beinhalten Vollwaschmittel neben Tensiden unter anderem auch Bleichmittel, optische Aufheller, Wasserenthärter, Enzyme, Schauminhibitoren und Duftstoffe.


Um unsere Textilien optimal zu pflegen und ihre Funktion zu erhalten, ist es wichtig, dass wir das richtige Waschmittel wählen und die Pflegeanleitung beachten.

Das Wasch-Chaos
Was bedeuten folgende Pflegesymbole, die man auf Etiketten von Kleidung oder anderen Textilien wie Decken findet?
Die Rolle des Wassers
Die meisten Reinigungsmittel werden in Verbindung mit Wasser eingesetzt. Es verteilt das Mittel, reinigt die Wäsche (z. B. indem es Verschmutzungen aufweicht und löst) und trägt den Schmutz weg. Die Wasserhärte hat Einfluss auf die Reinigungswirkung (Waschkraft) von Seifen und Waschmitteln.
Info für Lehrer*innenDie Wasserhärte kommt durch im Wasser gelöste Salze (z. B. Ca(HCO3)2, Mg(HCO3)2) zustande. Diese sind wichtig für unsere Mineralstoffversorgung. Bei der Benutzung von Reinigungsmitteln und Haushaltsgeräten hat die Wasserhärte aber Nachteile. Da sich Ca2+- und Mg2+-Ionen an Seifen-Anionen binden, kommt es zur Bildung schwer löslicher Kalkseifen, die sich an Oberflächen und in Abwasserrohren ablagern. Da dadurch auch die wirksame Tensid-Menge verringert wird, hat die Seife (bzw. das Waschmittel) eine geringere Waschkraft.

Beim Erhitzen des Wassers reagiert ein Teil der Ionen zu unlöslichem Kalk (Calciumcarbonat, CaCO3), der sich auf dem Gerät (z. B. den Heizstäben der Waschmaschine) absetzt
| + | + |
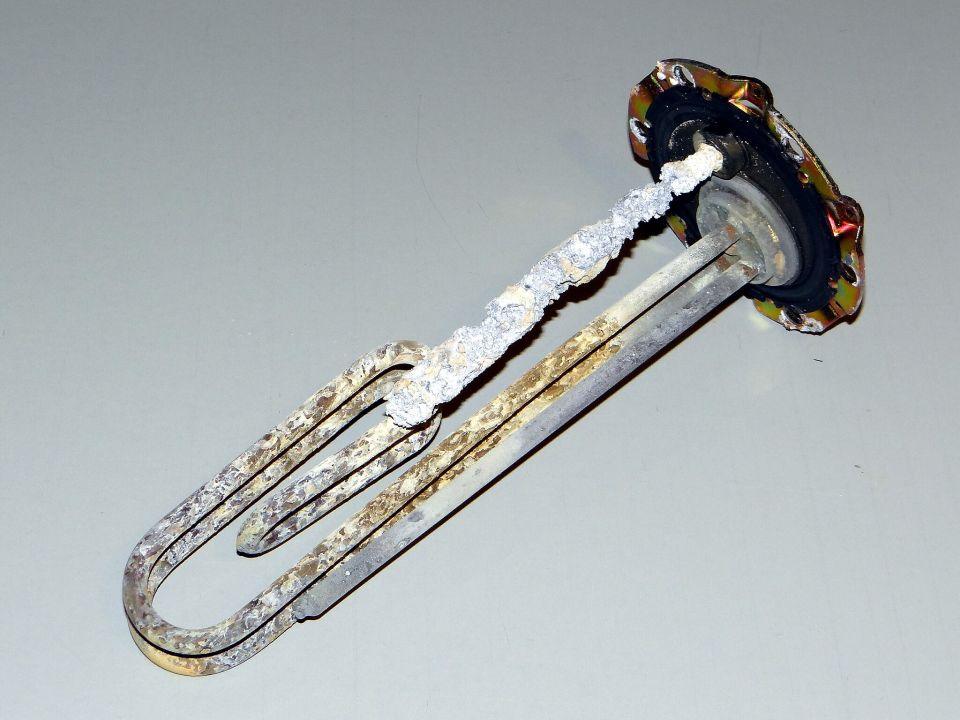
Um Kalkseifen und Kesselsteinbildung zu verhindern, sind in Vollwaschmitteln Wasserenthärter enthalten. In Gegenden mit hartem Wasser sollte man einen zusätzlichen Wasserenthärter einsetzen. Sie entfernen Ca2+- und Mg2+-Ionen aus dem Wasser. Dafür werden heute beispielsweise Aluminiumsilikate (wie Zeolith A) und Zitrate verwendet.
Info für Lehrer*innenHärtebereiche nach den deutschen Härtegraden (°dH):
| Härtebereich | °dH |
|---|---|
| weich | unter 10 |
| mittel | 10 bis 16 |
| hart | über 16 |
Umgang mit Reinigungsmitteln
Bei der Herstellung und Verwendung von Reinigungsmitteln dürfen die menschliche Gesundheit, Abwasseranlagen, Trinkwasser und Gewässer nicht beeinträchtigt werden. Beim Einsatz von Tensiden in Reinigungsmitteln muss darauf geachtet werden, dass diese biologisch abbaubar sind. Daher sollte man im Gebrauch sparsam mit Reinigungsmitteln umgehen und die Verwendungshinweise beachten.

Reinigungs- und Desinfektionsmittel, die Hypochlorite (OCl-) oder Chloride (Cl-) enthalten, dürfen nicht mit sauren Reinigern (wie Essigreiniger) verwendet werden, da dabei giftiges Chlorgas freigesetzt werden würde.
| Oxonium-Ionen | Hypochlorit-Anion | Chlorid-Anion | Wasser | Chlorgas | ||||
|---|---|---|---|---|---|---|---|---|
| + | OCl- | + | Cl- | + |
Cl2

|
Sammelt gemeinsam Tipps zur Auswahl und Verwendung von Reinigungsmitteln!